关于SiO2晶体的叙述中,正确的是( )
| A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) |
| B.60 g SiO2晶体中,含有2NA个Si—O键 |
| C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点 |
| D.SiO2晶体中含有1个硅原子,2个氧原子 |
下图表示取1 mol乙烯雌酚进行的4个实验,下列对实验数据的预测与实际情况吻合的是
| A.①中生成7 mol H2O | B.②中生成2 mol CO2 |
| C.③最多消耗3 mol Br2 | D.④中最多消耗7 mol H2 |
下列实验方案正确且能达到相应实验预期目的的是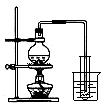
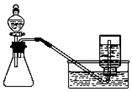
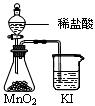
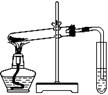
①② ③ ④
| A.①制取少量蒸馏水 | B.②用铜和浓硝酸制取少量NO2 |
| C.③比较MnO2、Cl2、 I2的氧化性 | D.④探究NaHCO3的热稳定性 |
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是
| A.质子数:c>b | B.离子的还原性:Y2->Z- |
C.氢化物 的稳定性:H2Y>HZ 的稳定性:H2Y>HZ |
D.原子半径:X<W |
将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
| A.H2S | B.NH3 | C.C12 | D.CO2 |
化学可以帮助人们形成对物质的科学认识,下列说法正确的是
| A.合成纤维和光导纤维都是新型的无机非金属材料 |
| B.维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好 |
| C.水晶、陶瓷、玻璃的主要成分都是硅酸盐 |
| D.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 |