党的十七大报告指出:“加强能源资源节约和生态环境保护,增强可持续发展能力,坚持节约资源和保护环境的基本国策,发展环保产业.”
(1)下列有关做法不符合上述要求的是________.
| A.将煤液化、气化,提高燃料的燃烧效率 |
B.安装汽车尾气催化转化装置,使之反应:4CO+2NO2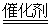 4CO2+N2 4CO2+N2 |
| C.大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃烧电池汽车 |
| D.在水力发电、火力发电、核能发电和风力发电中要大力发展火力发电 |
(2)将煤转化为水煤气的主要化学反应为
C(s)+H2O(g) CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol ①
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②
O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol ③
O2(g)===CO2(g) ΔH=-283.0 kJ/mol ③
请回答:
①根据以上数据,写出C(s)与H2O(g)反应的热化学方程式:_____________________________________.
②水煤气不仅是优良的气体燃料,也是重要的有机化工原料,CO和H2在一定条件下可以合成:a.甲醇;b.甲醛;c.甲酸;d.乙酸.试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.
已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
(1)写出反应②的化学方程式为_________________________________________。
(2)反应④中每消耗1 mol G,转移电子的物质的量为______________。
(3)反应⑥的离子方程式是___________________________________________。
(4)实验室中保存I的方法是____________________________。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-=NO+2H2O ; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:。
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
(5)KMnO4在酸性溶液中发生还原反应的反应式:______。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。
(1)D装置中主要反应的离子方程式为;F仪器的作用是:;
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试液:
a. 氯化铁 b. 氯化亚铁 c. KMnO4(H+) d. 苯酚 e. 品红
若验证Cl2稍过量:取适量D中溶液滴加至盛有(选填一个符号)试剂的试管内,再加入_(选填一个符号)试剂,发生的现象是:。
A~G各物质间的关系如下图,其中B、D为气态单质。
请回答下列问题:
(1)物质C和E的名称分别为_____________________、_______________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________________;
若只能在加热情况下进行,则反应物A的化学式(分子式)为_______________________;
(3)反应②的化学方程式为___________________________________________________;
(4)新配制的F溶液应加入______________以防止其转化为G。检验G溶液中阳离子的常用试剂是__________________,实验现象为_____________________________________。
计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压强pPa的情况下,19.5g A与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m)。缺少的数据是,
计算式为m=。
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。缺少的数据是,计算式为