某同学用如下装置,进行有关碳及其氧化物的实验(图中固定试管的仪器已略去)。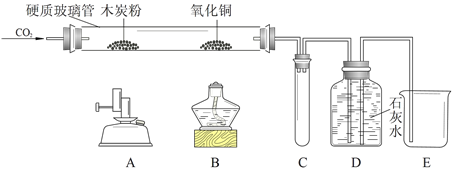
| 步骤 |
现象 |
分析 |
| ①点燃A处酒精喷灯,一段时间 |
木炭粉减少,D中有气泡、石灰水变浑浊且 (1) 。 |
硬质玻璃管中发生反应的化学方程式是 (2) 。 |
| ②点燃B处酒精灯,一段时间 |
B处 (3) ,D中石灰水变浑浊,液面下降。 |
氧化铜发生反应的化学方程式是 (4)。 |
| ③停止通入二氧化碳,熄灭A、B两处火焰 |
C中 (5) |
|
实验讨论:有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由(10)
小明和小红对市场上销售的一种分袋包装的豆奶粉发生了兴趣,因为豆奶粉装在充满气体的小塑料袋内,袋内的气体充得鼓鼓的,看上去好象一个小“枕头”,他们认为这种充气包装技术,主要是为了使食品长时间地保鲜、保质,那么这是什么气体呢?
小红猜想是氮气,小明猜想是二氧化碳
(1)请你设计一个简单的实验探究,判断小明的猜想是否正确
| 验证方法及操作 |
可能看到的现象 |
结论 |
(2)你认为食品充气包装,对所充气体的要求是:
①;
②;
③。
(1)小云从电视新闻中了解到:国家新版《生活饮用水卫生标准》已从今年7月1日起强制实施,其中饮用水消毒剂除了目前采用的液氯以外,补充了——氯胺(NH2Cl)、臭氧(O3)。
①O3中氧元素的化合价是。
②NH2Cl由(填数字)种元素组成,其中氮元素与氢元素的质量比是。
③NH2Cl用消毒时,发生反应NH2Cl+X==NH3+HClO,其中X的化学式是。
(2)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| Ⅰ |
1.2g |
||
| Ⅱ |
1.2g |
CuO 0.5g |
|
| Ⅲ |
1.2g |
MnO2 0.5g |
①上述实验应测量的“待测数据”是。
②若实验Ⅱ比实验Ⅰ的“待测数据”更(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
③将实验Ⅱ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,再将黑色粉末放入试管中,。(简述操作和现象)
【预期结论】氧化铜还能作氯酸钾的催化剂。
【评价设计】你认为小雨设计实验Ⅲ和实验Ⅱ对比的目的是。
(3)小雪用如下图所示装置制取氧气的相关数据如下表。回答有关问题: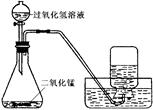
| 气体发生装置内物质的总质量 |
|
| 反应前 |
35.6g |
| 反应后 |
34.8g |
①反应生成氧气的质量为g(结果精确到0. 1 g,下同)。
②计算参加反应的过氧化氢的质量,写出必要的计算过程。
现将下列物质进行加热:①10g氯酸钾②3g二氧化锰③10g氯酸钾和3g二氧化锰的混合物④10g氯酸钾和3g高锰酸钾的混合物,反应完毕后,请问: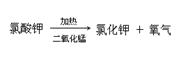
(1)用序号填写:产生氧气最多的是_______,不产生氧气的是________,产生氧气速度最慢的是.
(2)上述③中药品反应完毕后,试管内残留的两种固体__________________(填写物质名称)
现有氯酸钾、二氧化锰、锌粒、稀硫酸、氧化铜等药品,请利用所给的药品结合下列实验装置图回答问题.(收集装置不能重复使用)
A  B
B  C
C 
D  E
E F
F 
(1)写出实验室制取氧气的文字表达式______________________;制取氧气应选用的装置是_______和_______。(填字母)
(2)实验室制取氢气应选用的装置是_________和_________。(填字母)
(3)实验室中一般用铜与浓硝酸在常温下反应迅速产生二氧化氮气体。二氧化氮气体比氧气密度大,易溶于水。试用你学过的实验室制氧气和制氢气的知识回答:实验室用于制二氧化氮气体的发生装置可用(填序号)_________,收集二氧化氮气体的装置为_________
如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表。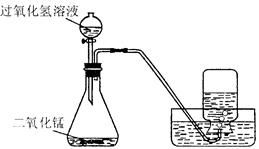
| 气体发生装置内物质的总质量 |
|
| 反应前 |
35.6 g |
| 反应后 |
34. 8 g |
(l)实验中检查该装置气密性的方法是________________________________ 。
(2)实验中集气瓶收集满氧气的现象是________________________________。
(3)反应生成氧气的质量为:_______________ g 。