已知向含有Zn2+的溶液中滴加氨水,有白色沉淀Zn(OH)2生成,继续滴加氨水使其过量,沉淀又溶解,生成了[Zn(NH3)4]2+。此外,Zn(OH)2既可溶于盐酸,又可溶于过量的NaOH溶液生成[Zn(OH)4]2-。所以Zn(OH)2是一种两性氢氧化物。现有四组离子,每组有两种金属离子,请各选一种试剂,将它们两者分开,可供选择的试剂有
| A.硫酸 | B.盐酸 |
| C.硝酸 | D.氢氧化钠溶液 |
E.氨水
根据上述内容填写下表:
| 离子组 |
选用试剂(字母代号) |
沉淀物化学式 |
保留在溶液中的离子 |
| ①Zn2+和Al3+ |
|
|
|
| ②Zn2+和Mg2+ |
|
|
|
| ③Zn2+和Ba2+ |
|
|
|
| ④Mg2+和Al3+ |
|
|
|
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则A的原子序数为_______,B为(填元素符号,下同)_____ ____,C为____________。
画出A的原子结构示意图:__________________,C的离子结构示意图:__________________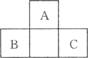
用电子式表示C的氢化物分子的形成过程:
(11分,最后一空为2分,其余各1分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是
(2)化学性质最不活泼的元素的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是,碱性最强的
碱是 呈两性的氢氧化物是;
(4)在③~⑦元素中,原子半径最大的是,原子半径最小的是 ;
(5)在⑦与⑩的单质中,氧化性强的是,可用什么化学反应说明该事实(写出反应的化学方程式):
有 X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)由X、Y 构成的10电子化合物的分子式;基态 Y原子的核外电子排布式为。
(2)离子Z3—的中心原子轨道杂化类型为,离子Z3—的空间构型为;
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是
;
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为
。
(12分 )水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为___;
(2)写出与H2O分子互为等电子体的微粒____(填1种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
| A.氧原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 第 6页 共 8页 |
| C.微粒的化学性质发生了改变 |
| D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)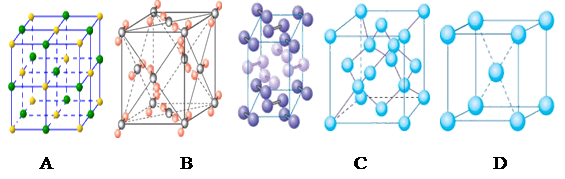
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。
请写出生成此配合离子的离子方程式:___。
某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点, 阴离子Y(○)位于立方体的中心,试分析:(1)晶体中Y的配位数是;X的配位数是;该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有个。
(3)该晶体的摩尔质量为Mg/mol,晶体密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间的距离为
cm。