使用化石燃料的汽车在给人类带来便利的同时,其排放出的尾气也会污染环境,降低汽车尾气有害成份是减轻大气污染的重要途径;研制开发使用新型能源的汽车更具有现实意义。
(1)已知下列热化学方程式:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
N2 (g)+O2(g)=2NO(g) ΔH=+27kJ·mol-1
加装有催化转化器的汽车尾气排放时反应方程式为:2NO(g)+2CO(g) N2(g)+2CO2(g) ,该反应的ΔH为________;假设此变化过程热量变化共有59.3kJ,则转移的电子为______NA(NA表示阿伏加德罗常数)。
N2(g)+2CO2(g) ,该反应的ΔH为________;假设此变化过程热量变化共有59.3kJ,则转移的电子为______NA(NA表示阿伏加德罗常数)。
(2)某科研机构在实验室中对NO、CO之间的反应进行了探究:他们将2molNO、1molCO充入一个1L固定容积的容器中,测出反应过程中各物质的浓度变化并绘制成右图(0~15min内)
①此温度下该反应的平衡常数为__________;15min时,改变某种条件后c(N2)变化如下图(15min~35min)所示,则改变的条件可能是____

a.降低温度 b.缩小容器容积
c.增加CO2的量 d.升高温度
②若N2在0~5分钟、10~15分钟、15~30、30~35分钟的平均反应速率分别记为 (0~5)、
(0~5)、 (10~15)、
(10~15)、 (15~30)、
(15~30)、 (30~35)。四者之间的大小关系为________________,
(30~35)。四者之间的大小关系为________________,
③若保持温度不变,在12min时再向容器中充入CO、N2各0.6mol,则平衡将___________移动(填“向左”、“向右”、“不”)。
(3)高铁电池具有能量密度高、原料丰富成本低廉,绿色无污染不需要回收等特点,它己成为电动汽车首选的电池,其工作原理为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+4KOH
3Zn(OH)2+4KOH
+2Fe(OH)3。则放电时,负极材料是________,正极上的电极反应式为_________________充电时阴极附近溶液pH_______(填增大、减小、不变)。
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为,反应中消耗1mol的MnO4—时转移电子数为。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是,又变为棕黄色的原因是。
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。



试回答:
(1)B装置中Cu电极上的电极反应式为,D装置中Fe电极上的电极反应式为。
(2)D装置中的实验现象有,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是(填B或C)。
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL)(标况下) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,你认为原因是。
(2)4~5 min时间段的反应速率最小,你认为原因是。
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2OB.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末
你认为可行的是(填编号)。
如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题: 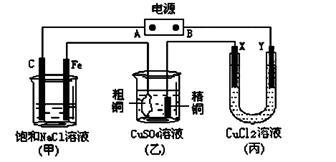
(1)在电源中,B电极为极(填电极名称,下同);丙装置中Y电极为极。
(2)在甲装置中,石墨(C)电极上发生反应(填“氧化”或“还原”);甲装置中总的化学方程式是:。
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
L。
下图是红磷P(s)和Cl2反应生成 (图中的
(图中的 表示生成1mol产物的数据)。根据下图回答下列问题:
表示生成1mol产物的数据)。根据下图回答下列问题:
(1)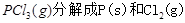 的热化学方程式为。
的热化学方程式为。
(2)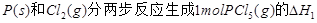 =KJ·mol-1
=KJ·mol-1
(3)研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量,表1所列是部分化学键的键能数据。
表1部分化学键的键能数据
| 化学键 |
P-P |
P-O |
O=O |
P=O |
| 键能/(kJ·mol-1) |
198 |
360 |
498 |
x |
已知1mol白磷(结构如下图所示,分子式为P4)完全燃烧生成P4O10(结构如下图)放出2982KJ热量,则表中:x=。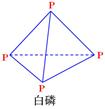 (P4O10)
(P4O10)