[化学一化学与技术]
金属钛(Ti)因为具有许多神奇的性能越来越引起人们的关注,被誉为“未来金属”。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钒钛磁铁矿经“选矿”得到的钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如下:
(1)从金属矿石中提炼金属一般需要经过三个阶段,上述工艺溶度积中涉及的有矿石中金属元素的还原、矿石的富集、金属的精炼;没有涉及的一个阶段是______________;生铁实际上属于铁______等元素形成的合金。若生产中碳的氧化产物主要为一种可燃性气体,请写出反应②的化学方程式__________________________。
(2)生产中碳除了用还原剂还原还原金属矿物外,还有一个重要作用是______________;反应③是在氩气的环境中进行,目的是_____________________,如何从反应③后的固体中获得金属钛_______________________________。
(3)已知在氯化过程中还有一种副产物VOCl3生成,实际生产中常在409K时用铜还原VOCl3,得到不溶于TiCl4的VOCl2,当有1molCu参加反应时转移的电子数为NA,试写出该反应的化学方程式为___________________。
(10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
(1)写出溶液B的溶质是。
(2)参照以下框图形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)。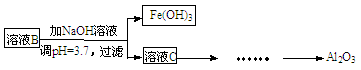
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。写出反应的离方程式:。
硅基太阳电池需用化合物甲作钝化材料,甲的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g甲与6 g H2。工业上制乙的流程如下: 请回答下列问题:
请回答下列问题:
(1)乙的电子式是;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有(填字母编号)。
| A.O2 | B.H2 | C.N2 | D.CO2E.Ar |
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式。请设计验证产物盐M的实验方案。
(12分)人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 |
待测血液的体积/mL |
滴入KMnO4溶液的体积/mL |
| 1 |
20.00 |
11.95 |
| 2 |
20.00 |
13.00 |
| 3 |
20.00 |
12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(16分)碳及其化合物有广泛的用途。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
(2) 已知:C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)  CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3) CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) =CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为_______________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4) 将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)________________________。
(5) 工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
请回答下列问题:①与实验Ⅰ比较,实验Ⅱ改变的条件为____________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。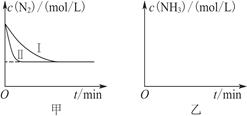
(15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。