硅基太阳电池需用化合物甲作钝化材料,甲的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g甲与6 g H2。工业上制乙的流程如下: 请回答下列问题:
请回答下列问题:
(1)乙的电子式是 ;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是 。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有 (填字母编号)。
| A.O2 | B.H2 | C.N2 | D.CO2E.Ar |
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式 。请设计验证产物盐M的实验方案 。
按要求书写热化学方程式:
① 1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2 kJ热量:
② 稀盐酸和稀NaOH溶液混合的热化学方程式:
③2 gH2完全燃烧生成液态水放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:
④ 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:
在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使发生反应:I2(g) + H2(g) 2HI(g)△H<0。
2HI(g)△H<0。
(1)保持容器容积不变,向其中加入1molH2,反应速率(填“增大”、“减小”或“不变”,下同);保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率。
(2)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率;保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率。
(3)若容器体积为10L,反应达平衡时,测得c(H2)=0.08mol/L,则该反应的平衡常数K=。
(4)在上述温度下,该10L容器中若通入H2和I2蒸气各2mol,则达到平衡时c (H2)=。
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
2SO2(气)+ O2 (气) 2SO3(气)△H<0。
2SO3(气)△H<0。
根据化学平衡原理来确定的条件或措施有(填序号)。
A 为提高SO2的转化率,加入过量的空气
B 含SO2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒
C 使用作V2O5催化剂
D.反应条件不使用很高温度
E.氧化反应在常压下进行
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系
如下图所示。根据图示回答下列问题: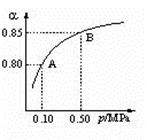
①将2 mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,体系的总压为0.10MpPa,该反应的平衡常数为。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(3)若实验室在催化剂存在的条件下,向某密闭容器中充入1.6molSO2和0.8molO2,此时容器体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.50,SO2的转化率为α。
①达平衡时混合气体的体积为_________,α为_________;
②若保持温度和压强不变,平衡时再充入1 molSO3,则平衡时SO2体积分数为;
③若起始时充入x mol SO2、y molO2和z mol SO3,在,反应达平衡时,测得混合气体的体积为120 L,SO3体积分数仍为0.5。则x、 y应满足的关系式为,x、z应满足的关系式为。
④在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO2和0.8molO2到达平衡时,SO2的转化率_______α(填“大于”、“小于”或“等于”)
(4)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后在加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:正极的电极反应式是。
负极的电极反应式是。
(3)下图是一个电化学过程示意图。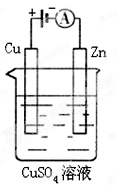
①锌片上发生的电极反应是。
②假设使用肼空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方
程式是。
已知H2A在水中存在以下平衡:H2A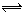 H++HA-,HA-
H++HA-,HA-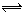 H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定” ,下同),某二元酸H2B电离方程式是:H2B H++HB-,HB- B2-+H+,NaHB溶液________。
B2-+H+,NaHB溶液________。
(2)某温度下,向0.1 mol/L的NaHA溶液中滴入0.1 mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2/L2B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) 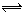 Ca2+(aq)+A2-(aq) ΔH>0。
Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。