工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH 一(aq)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在下列有关说法中,正确的是( )
| A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大 |
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O 达到平衡状态 Cr2O72—(橙色)+H2O 达到平衡状态 |
| C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。 |
| D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽 |
一种新型燃料电池,一极通入空气,另一极通入C4H10气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
①在熔融电解质中,O2-由负极移向正极②电池的总反应是:2C4H10+13O2====8CO2+10H2O③通入空气的一极是正极,电极反应为:O2+4e-====2O2-
④通入C4H10的一极是正极,电极反应为:C4H10+26e-+13O2-====4CO2+5H2O( )
| A.①② | B.②③ |
| C.①③ | D.②④ |
下列事实不用电化学理论解释的是( )
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.铝片不用特殊方法保护 |
| C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D.镀锌铁比镀锡铁耐用 |
根据下列实验事实
(1)X+Y2====X2+Y(2)Z+2H2O Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+的氧化性比X2+弱(4)由Y、W电极组成的原电池,电极反应为W2++2e-="===W" Y-2e-====Y2+
可知X、Y、Z、W的还原性由强到弱的顺序是( )
| A.X>Z>Y>W |
| B.Z>W>X>Y |
| C.Z>X>Y>W |
| D.Z>Y>X>W |
关于如图所示装置的叙述,正确的是( )
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)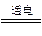 2Na+Cl2↑ 2Na+Cl2↑ |
B.MgO+H2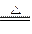 Mg+H2O Mg+H2O |
C.Fe3O4+4CO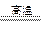 3Fe+4CO2 3Fe+4CO2 |
D.2HgO 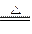 2Hg+O2↑ 2Hg+O2↑ |