常温下,0.1mol/L某一元酸(HA)的pH>1,在0.1mol/L某一元碱(BOH)中H+和OH—离子物质的量浓度的关系为: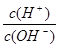 =10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )
=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )
A. C(B+)>C(A-)>C(OH-)>C(H+)
B. C(A-)>C(B+)>C(H+)>C(OH-)
C. C(B+)=C(A-) + C(HA)
D. C(B+)+ C(H+)=C(A-)+ C(OH-)
下列说法正确的是()
| A.烷烃的熔沸点随分子中碳原子数的增多而降低。 |
| B.甲烷和乙烯都可以与氯气反应 |
| C.高锰酸钾可以氧化乙烯和甲烷 |
| D.乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚氯乙烯 |
有X、Y、Z、W四种主族元素,已知X、Y的阳离子和Z、W的阴离子都具有相同的电子层结构,而且原子半径X>Y;阴离子所带负电荷数Z>W。则四种元素的原子序数关系是()
| A.X>Y>Z>W | B.Y>X>W>Z | C.Z>Y>X>W | D.Y>X>Z>W |
日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2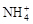 +2e-=Mn2O3+2NH3+H2O。
+2e-=Mn2O3+2NH3+H2O。
下列有关锌-锰干电池的叙述中,正确的是()
| A.干电池中锌筒为正极,石墨棒为负极 |
| B.干电池工作时,电流方向是由锌筒经外电路流向石墨棒 |
| C.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器 |
| D.干电池可实现化学能与电能的相互转化 |
右图是元素周期表的一部分,下列说法中正确的是()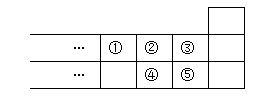
| A.元素①位于第二周期第ⅣA族 |
| B.气态氢化物的稳定性:④>② |
| C.最高价氧化物对应水化物酸性:⑤>④ |
| D.元素的最高正化合价:③=⑤ |
已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2﹣易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是()
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |