水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。
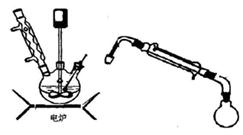
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是 。
(2)步骤2检测NaClO浓度的目的是 。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应 (选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是 。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为 。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:
实验室要用Na2CO3·10H2O晶体配制500 mL 0.1 mol·L-1 Na2CO3溶液,回答下列问题:
(1)应该用托盘天平称取Na2CO3·10H2O________g。
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容量瓶底部有水珠______________________________________;
B.定容时加水超过刻度线________________________________________;
C.最终定容时俯视观察液面 。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放250 mL足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加了8 g。常温下各烧杯中溶液的pH与电解时间t的关系图如下。据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”)。
(2)计算电极e上生成的气体在标准状况下的体积为_________________。
(3)B溶液中的溶质为 。电解后,乙烧杯中溶液的pH=__________。 若在B溶液中事先滴加紫色石蕊试液, 极(填写“c”或“d”)先变红。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题: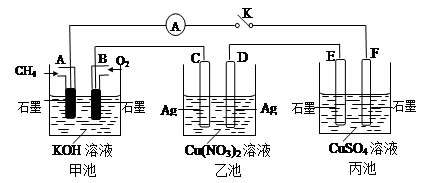
(1)甲池A电极的电极反应式为 。
(2)丙池中电解反应的方程式是 。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
用质量分数为98%密度为1.84g·cm-3的浓硫酸配制250mL物质的量浓度为2mol·L-1的稀硫酸。其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸, (简述浓硫酸稀释的操作),冷却
B.检查 (填所用仪器名称)是否漏水
C.用蒸馏水洗涤烧杯和玻璃棒2~3次,将每次的洗涤液都转移入容量瓶里
D.将稀释后的硫酸小心地用玻璃棒引流至容量瓶里
E.盖紧瓶塞,上下倒转摇匀溶液
F.将蒸馏水直接加入容量瓶至刻度线以下2cm处
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到凹液面最低点恰好与刻度线相切
请据此填写:
(1)完成上述步骤中的空白处。
(2)正确的操作顺序是(用字母填写):()→()→()→()→()→()→()
(3)进行A步操作时,选用量筒的规格是 。(选填字母)
A.10mL B.50mL C.100mL D.1000mL
(4)下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
①.用量筒量取浓硫酸时俯视,则 ;
②.A 步操作时,浓硫酸稀释后,未冷却即进行下一步操作,则_________;
③.定容时仰视溶液的凹液面,则_________。
海洋植物如海带.海藻中含有丰富的碘元素,其主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知: 2I—+ Cl2=2Cl—+I2)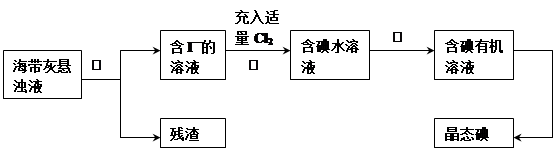
(1) 指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2) 过程②中充入适量Cl2的目的是 ;
(3) i)操作③中所用的有机试剂可以是 (填代号)
A.乙醇(与水互溶) B.四氯化碳 C.甲烷气体 D.食盐水
ii)简述要把碘水变成碘有机溶液对于提取晶体碘的优点 。
(4) 操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E. ;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(a) 过程③的操作顺序是 C、 B、 D、 A、 H、 G、 E、 F,则E的操作步骤是 ;
(b) 上述G步操作的目的是: ;
(c) 最后碘的有机溶液是通过 获得(填“漏斗上口”或“漏斗下口”)。