列几组物质中,互为同位素的有__________,互为同素异形体(同一种元素形成的不同的单质)的有________,互为同系物的有____________,互为同分异构体的有____________________,属于同种物质的有__________。
①O2和O3 ②35Cl和37Cl ③CH3CH3和CH3CH2CH3 ④CH3CH2CH(CH3)CH2CH3和
CH3CH2CH(CH3)CH(CH3)CH3
⑤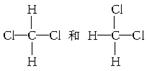
⑥CH3(CH2)2CH3和(CH3)2CHCH3 ⑦CH3CH(CH3)CH3和CH(CH3)3
(1)维生素C的结构简式为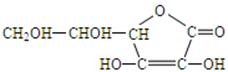
请回答:①维生素C的分子式是
②向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水
溶液显 性。
性。
(2)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。维生素C在这一反应中具有性;维 生素C又称为。
生素C又称为。
合金与各成分的金属相比,其特点为硬度比纯金属___ _____,熔点比比各成分金属 _____________。
_____,熔点比比各成分金属 _____________。
人的血液呈 (酸性,弱酸性,中性,碱性,弱碱性),我国居民形成了摄入蔬菜和水果偏少的习惯,一般尿液呈 性(偏酸,中性,偏碱)。
某药品标签上贴有OTC,它表示  。阿司匹林的化学学名是,青霉素G的钠盐俗名叫
。阿司匹林的化学学名是,青霉素G的钠盐俗名叫
黄铜是生活中常用的金属材料,它是铜和_______的合金(填名称)。