乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: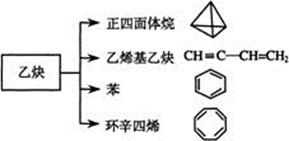
(1)正四面体烷的分子式为 ,其三氯取代产物有 种
(2)关于乙烯基乙炔分子的说法正确的是:
a. 不能使酸性KMnO4溶液褪色
b. 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
c. 乙烯基乙炔分子中的四个C原子可能在一条直线上
d. 1摩尔乙烯基乙炔能与3摩尔Br2发生取代反应
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例): 。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试回答:
(1)写出A和C组成的化合物的电子式________________________________;
(2)B的离子结构示意图是,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该盐的化学式是;
(3)写出C元素的单质和甲烷发生一元取代反应的化学方程式____________________;
(4)写出A最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式:
。
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。 正极 ,负极 ,电解质溶液 ,电极反应式、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A称量的是长期暴露在空气中的NaOH
B容量瓶不干燥
C将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切
已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。
请回答:
(1)若A为金属单质Fe,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色晶体,则B的分子式为_________,A和E在一定条件下反应生成D的化学方程式为。
(2)若A为非金属单质,B为金属单质,C为常见酸,且C的组成中含有与A相同的元素。则C的分子式为___________,A和E在一定条件下反应生成D的离子方程式为。
(3)若A、C分别为常见强酸和常见强碱,B为金属氧化物,则B的分子式为_________,A和E在一定条件下反应生成D的离子方程式为。
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有和。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
| 体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为________。
③试分析1~3min时间段里,反应速率变大的主要原因。
(3)对于容积固定的反应:N2(g)+3H2(g)  2NH3(g)(正反应放热),达到平衡的标志有___。
2NH3(g)(正反应放热),达到平衡的标志有___。
A N2、H2、NH3的百分含量不再变化 B总压强不变
C N2、H2、NH3的分子数之比为1∶3∶2 D N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量
Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60);②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);
⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的, (2)是同位素的,(3)是同分异构体的。
Ⅱ.在下列变化中:①干冰气化 ②硝酸钾熔化 ③食盐溶于水 ④HCl溶于水 ⑤蔗糖溶于水 ⑥HI分解。用序号填空:(1)未破坏化学键的是,(2)仅离子键被破坏的是,
(3)仅共价键被破坏的是。
Ⅲ. A~E是几种烃分子的球棍模型,据此回答下列问题:
(1)常温下含碳量最高的气态烃是___________(填字母);
(2)能够发生加成反应的烃有____________(填字母);
(3)一卤代物种类最多的是_____________(填字母);
(4)写出C与溴水反应的化学方程式______________。