右图是可逆反应X2 + 3Y2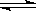 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是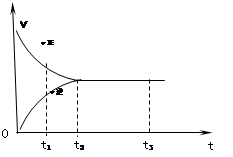
| A.t1时,只有正方向反应 |
| B.t2时,反应没有到达限度 |
| C.t2- t3,反应不再发生 |
| D.t2- t3,各物质的浓度不再发生变化 |
下列关于F、Cl、Br、I性质的比较,不正确的是
| A.它们的原子核外电子层数随核电荷数的增加而增多 |
| B.单质的熔沸点随核电荷数的增加而增加 |
| C.它们的氢化物的稳定性随核电荷数的增加而增强 |
| D.单质的颜色随核电荷数的增加而加深 |
下列各组物质中,互为同位素的是
A.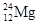 和 和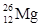 |
B.O2和O3 | C.NO和NO2 | D.H2O和H2O2 |
下列递变规律不正确的是
A. Na、Mg、Al还原性依次减弱 B. I2、Br2、Cl2氧化性依次增强
C. C、N、O原子半径依次增大 D. P、S、Cl最高正价依次升高
一定条件下,在密闭容器中进行反应:2SO2(g)+ O2(g) 2SO3(g)。当SO2、O2、SO3
2SO3(g)。当SO2、O2、SO3
的浓度不再改变时,下列说法正确的是
| A.SO2、O2完全转化为SO3 | B.正、逆反应速率相等且等于零 |
| C.反应已达到化学平衡状态 | D.SO2、O2、SO3的浓度一定相等 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为: Zn(s)+2MnO2(s)+H2O(l)﹦Zn(OH)2(s)+Mn2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-﹦Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |