牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图: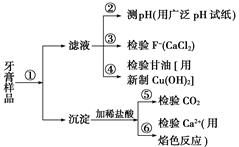
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是________,所需要的主要玻璃仪器有________________________________________________________________________。
(2)在②中用pH试纸测溶液的pH的操作方法是
________________________________________________________________________
________________________________________________________________________。
(3)写出④中发生反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(4)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和________溶液的反应来进行。
(1)臭氧层是指,其作用是,因此臭氧层被称为。20世纪80年代,科学家观测在和相继出现“臭氧空洞”---即臭氧层受损。
(2)臭氧层受损的原因:
化学方程式、、总反应Cl的作用为
(3)另外,、、以及也会破坏臭氧层。
(1)正常雨水PH为,这是因为的缘故。
(2)酸雨是指的降水,主要是由而形成的。
(3)形成酸雨的有关化学方程式为:、
(4)我国主要以型酸雨为主,是由我国以为主的能源结构造成的。
(1)清洁空气的组成为、、、、和。
(2)根据组成成分,可将大气污染分为、、、、、等。
(3)产生大气污染的主要途径有和。
(4)常见大气污染的危害主有、、。
塑料的主要成分是,在棉花、尼龙、涤纶、腈纶、羊毛、硝酸纤维中,属于天然纤维的是 ,属于人造纤维的是 ,属于合成纤维的是
已知胰岛素含硫的质量分数为3.4%,相对分子质量为5734,则每个胰岛素分子中所含的硫原子数为多少?___________________