(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________ ,
K值的大小与温度的关系是:温度升高,K值__________ (填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)高炉炼铁中发生的基本反应之一为:CO(g) + FeO(s)  CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
①升高温度,平衡移动达到新的平衡时,高炉内CO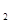 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
②1100℃时测得高炉中c(CO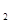 )="0.025"
)="0.025" 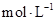 ,
,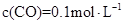 ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度
,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度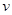 (正)__________
(正)__________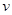 (逆)(选填“>”、“<”或“:”),其原因是________________。
(逆)(选填“>”、“<”或“:”),其原因是________________。
Ⅰ.麻黄素又称黄碱,是我国特定的中药材麻黄中含有的一种生成碱。经我国科学家研究发现其结构如下:
(1)麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
(2)下列各物质:

与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
Ⅱ.某烃类化合物A的相对分子质量为84,分子中含有一个碳碳双键,其分子中只有一种类型的氢原子。
(1)A的结构简式为______________________;
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)。
A~G是几种烃的分子球棍模型(如图),据此回答下列问题:

(1)常温下含碳量最高的气态烃是(填对应字母)________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)一卤代物种类最多的是(填对应字母)________;
(4)写出C与Br2发生加成反应的化学方程式______________________________________________;
(5)写出F发生硝化反应的化学方程式________________________________________________。
(1) 的名称是_______ _________________。
的名称是_______ _________________。
(2)2,4,6三甲基5乙基辛烷的分子中共有________个甲基原子团。
(3)分子中有6个甲基而一溴代物只有1种的烷烃的分子式是______________,其结构简式是_____________________________________________________,名称是____________________。
(1)请在下图所示分子的结构简式中用“*”标记出手性碳原子。若用该有机物进行核磁共振实验,所得核磁共振氢谱有________个峰,强度比为________。
(2)已知某硼烷相对分子质量为28,核磁共振氢谱有两个峰且强度比为1∶2,则该硼烷的分子式是________,已知该硼烷气体在空气中能剧烈燃烧生成三氧化二硼和水,且生成1 mol液态水可放出722 kJ的热量,请写出燃烧的热化学方程式:____________________________。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是__________,名称是__________。
(2)①的反应类型是__________;②的反应类型是__________。
(3)反应④的化学方程式是________________________________________