某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
| 1 |
Mg Al |
稀盐酸 |
偏向Al |
| 2 |
Al Cu |
稀盐酸 |
偏向Cu |
| 3 |
Al 石墨 |
稀盐酸 |
偏向石墨 |
| 4 |
Mg Al |
NaOH溶液 |
偏向Mg |
| 5 |
Al Zn |
浓硝酸 |
偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同?
________________________________________________________________________。
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。
铝为( ):
________________________________________________________________________。
石墨为( ):
________________________________________________________________________。
电池总反应:
________________________________________________________________________。
(3)实验4中的铝作正极还是负极?________,为什么?
________________________________________________________________________
________________________________________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:
________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?________________________________________________________________________
________________________________________________________________________。
现有A、B、C三种短周期元素,原子序数依次递增。A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸 反应,收集到气体1.12L(标准状况)。请回答下列问题:
反应,收集到气体1.12L(标准状况)。请回答下列问题:
(1)B元素在元素周期表中的位置是
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)
(3)A、B两元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式
为
(4)将B单质与石墨按右图装置连接,石墨电极的名称为
;另一电极反应式为:。
(5)C的一种氧化物是常见的大气污染物。为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4·2H2O)。假设在转化过程中C元素不损失,每天处理1120 m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上
m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上 可以得到多少千克石膏?
可以得到多少千克石膏?
一种原电池的组成如图所示。试回答下列问题(灯泡功率合适):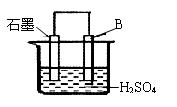
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填
“不亮”做②题)。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为;其价电子核外电子排布式为,Al与NaOH溶液反应的离子方程式为:
(2)30Si的原子的中子数为;SiO2晶体类型为晶体
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:
(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①和②。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是。
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为,1mol Y2X2含有σ键的数目为
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为。