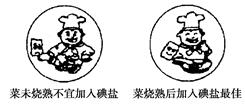
如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此你得到的信息和作出的推测是( )
 配料表
|
A.人体不能缺碘,需要正常补碘,“加碘食盐”中的“碘”是指碘单质
B.该食盐商品是以海盐为原料,经过加工后的产品,是盐类的纯净物
C.1 kg此食盐中含碘酸钾(35±15) mg
D.“菜未烧熟不宜加入碘盐”的原因可能是碘酸钾受热不稳定
若不小心误将水加入你家里的食用花生油里,你将采用下列何种方法分离
| A.过滤 | B.分液 | C.渗析 | D.萃取 |
根据我省中心气象台报道,近年每到春季,我省沿海一些城市多次出现大雾天气。根据物质的分类,雾属于下列分散系中的
| A.溶液 | B.悬浊液 | C.乳浊液 | D.胶体 |
实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。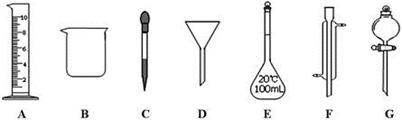
(1)写出仪器名称:E,F
(2)下列实验操作中用到仪器G的是(选填下列选项的编号字母)。
a.分离水和CC14的混合物
b.分离水和酒精的混合物
c.分离水和泥砂的混合物
(3)实验室配制100mL 0.5mol/L的盐酸溶液。
①下列关于仪器E的使用方法中,正确的是(选填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到容量瓶中
②需要10mol/L的浓盐酸mL。取用该体积盐酸时,需要用到上述仪器中的A和(选填仪器的编号字母)。
下列有关物质检验的实验结论正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
| C |
加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊 |
该溶液中一定有CO32- |
| D |
用洁净的铂丝蘸取某溶液,在无色火焰上灼烧,观察到火焰颜色为黄色 |
该溶液中一定含有Na+,可能含有K+ |
下列叙述正确的是
| A.在Na2O2与H2O反应中,Na2O2是氧化剂,H2O是还原剂 |
| B.Na2O与Na2O2中阴离子个数与阳离子个数之比均为1:2 |
| C.用氯化钙溶液鉴别 NaHCO3和Na2CO3溶液 |
| D.质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,二者生成的CO2一样多 |