I甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: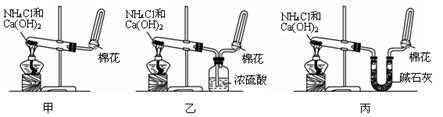
(1)三位同学制取氨气的化学方程式为:_____________________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是__________________________________.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是___________填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
__________________________________________________________________________________
_______________________________________________________________________________。
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是___________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4CL固体代替NH3?______________(填“能”或“不能”)。
II资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(6)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是__________________________________。
(7)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是__________________;试管内气体变为红棕色,该反应的化学方程式是_________________。
(8)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是________,其理由是_____________。
②氨气燃烧的化学方程式是______________________________。
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,一位同学设计了一种制备精盐的实验方案,步骤如下(用于生成沉淀的试剂均稍过量):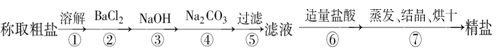
(1)判断BaCl2已过量的方法是______________________________。
(2)第④步中,相关的离子方程式是_________________________________。
(3)蒸发、结晶时,当时停止加热。
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液
| 应称取NaOH的质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它玻璃仪器 |
(2)容量瓶上需标有以下五项中的;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是,溶液注入容量瓶前需恢复到室温,这是因为_____________________________;
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 |
| B.加热分解 |
| C.结晶法 |
| D.分液法 |
E.蒸馏法
F.过滤法
(1)分离饱和食盐水和沙子的混合物:;
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:;
(3)分离水和油的混合物:;
(4)分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合:;
(5)从碘的水溶液中提取碘:。
无机化合物可根据其组成和性质进行分类:
(1)下图所示的物质分类方法名称是;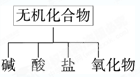
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面;(只需填一种)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的离子方程式;
有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有(选填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是、。
(3)写出与D、E具有相同官能团的所有同分异构体的结构简式____________、______________。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是:_____________________。
(5)某学生检验C的官能团时,取1mol/LCuSO4溶液和2mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的C,加热后无红色沉淀出现。该同学实验失败的原因可能是。(选填序号)
①加入的C过多 ② 加入的C太少 ③ 加入CuSO4溶液的量过多 ④ 加入CuSO4溶液的量不够