化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色 溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字 样。老师告诉他们,这瓶溶液中的溶质可能是氢氧化钠、氯化钠或碳酸钠。同学们很感兴趣,决定对其成分进行探究。
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应。
【作出猜想】(1)可能是 溶液;(2)可能是Na2CO3溶液;(3)可能是NaCl溶液。
【设计并实验】
| 实验 |
实验操作 |
实验现象 |
实验结论和解释 |
| I |
取样于试管中,向其中滴加几滴 。 |
无色溶液变红 |
该溶液不可能是 溶液,理由是 。 |
| II |
另取样于试管中,向其中滴加足量的 。 |
产生大量气泡 |
该溶液为碳酸钠溶液,有关反应的化学方程式为 。 |
由此,同学们得出结论:该溶液是碳酸钠溶液。
【反思】老师指出该结论不严密。理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象。老师提示,不需另取样,只要在实验Ⅰ后的试管中加入足量CaCl2溶液,若观察到 现象,即可说明该溶液中有氢氧化钠。
【2015年江苏省扬州市】一定条件下,CO与MgSO4反应会生成三种氧化物。某兴趣小组用如下装置探究该反应。
已知SO2,CO2均能使澄清石灰水变浑浊。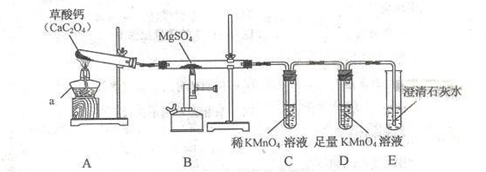
(1)仪器a的名称是 。CaC2O4中C的化合价是 。
(2)装置A中CaC2O4的分解会生成一种气体和一种相对分子质量为100的盐,则A中反应的反应化学方程式为 。
(3)实验时观察到装置C中紫红色褪去,装置E中溶液变浑浊,则在C和E中反应的气体分别是 ﹑ 。
(4)装置B中反应的化学方程式是 。装置D的作用是 。
(5)该装置的明显不足之处是 。
【2015年山东省济南市】已知某固体混合物A中可能含有CuSO4、FeCl3、NaNO3、 BaCl2、CaCO3五种物质中的两种或多种。按下述步骤进行实验探究,观察实验现象,并加以分析推理(设过程中所有发生的反应都恰好完全反应)。
I.取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入适量NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液C。
Ⅱ.另取一定质量的该固体混合物A放入另一洁净烧杯中,向其中加入适量H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液E。
Ⅲ.将所得滤液C和滤液E充分混合,再向混合后的溶液中加入适量AgNO3溶液,待充分反应后,过滤,得白色沉淀F和滤液G。
Ⅳ.根据上述实验过程和发生的现象做出相应推理,填写以下空白:
(1)在固体混合物A里,上述五种物质巾肯定存在的物质是(写化学式)_________________________
(2)写出步骤III中生成白色沉淀F的1个化学方程式____________________
(3)在滤液G中,含有的金属阳离子共有一一种,该滤液中肯定存在的酸根离子_______________。
(4)在混合物A里,上述五种物质中肯定不存在的物质是(写化学式)_________________________。
得出此结论的理由是_____________________________。
【2015年江苏省苏州市】中和反应在工农业生产和生活中有广泛的应用。某学生课外兴趣小组对中和反应进行研究。
(1)对于没有明显实验现象产生的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如下实验来进行。21世纪教育网版权所有
①在盛有稀氢氧化钠溶液的烧杯中,滴加2~3滴酚酞试液,用胶头滴管吸取稀盐酸逐滴加入到上述烧杯中,边滴边用玻璃棒搅拌,当观察到 现象时,说明它们之间发生了中和反应,且恰好完全反应。21cnjy.com
②将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度、pH进行实时测定,得到的曲线如图1、图2所示。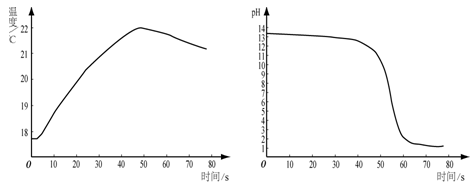
图1图2
由图1、图2可知,稀盐酸与稀氢氧化钠溶液已发生中和反应的判断依据是 。
(2)对于某些有明显实验现象产生的中和反应,如稀硫酸与氢氧化钡溶液的反应,只要将稀硫酸滴加到氢氧化钡溶液中,观察到 现象,就可说明反应已经发生。该反应的化学方程式是 。
【2015年四川省泸州市】将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如右图。某学习小组对加入0—— VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究: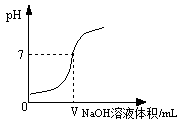
【猜想假设】
猜想Ⅰ:pH增大是因为 ;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7。
(2)向2mL0.4%的盐酸中加入VmL ,用pH计测得混合液的pH 7(填“>”、“=”或“<”)。综合(1)和(2)证明猜想Ⅱ成立。
【2015年福建省厦门市】有关NaOH与CO2反应的探究
探究一:检验NaOH固体样品露置空气中一段时间后的成分
【查阅资料】Na2CO3溶液是碱性;KCl溶液、BaCl2溶液显中性、BaCO3难溶于水。
(1)检验样品是否变质。检验样品成分中是否含碳酸根的实验方法(操作、现象及结论):
___________________________________________________________________________。
(2)检验样品是否完全变质。实验操作:取样品加水溶解,先加过量的_________(填编号,下同),再滴加________。
| A.盐酸 | B.KCl溶液 | C.BaCl2溶液 | D.Ba(OH)2溶液 E.酚酞试液 |
探究二:用NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数
【实验装置】如图所示,向细玻璃管内注入少量水,形成一段水柱;经检查该装置气密性良好。已知细玻璃管单位长度的容积为0.1mL·cm—1。水柱的质量忽略不计。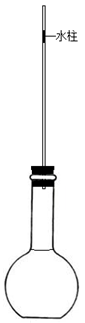
【操作步骤】保持外界条件不变,完成以下操作:
①将40mL浓NaOH溶液迅速倒入烧瓶内,立即塞紧橡皮塞,并在细玻璃管上标记水柱底部的位置
②观察并测量得出水柱缓慢向下移动的距离为2.0cm;
③实验结束后,根据①中的标记,测得该标记以下细玻璃管及烧瓶的总容积为340mL。
(3)检查图8装置气密性的操作方法:________________________________________。
(4)仅根据本次测量数据,该气体样品中酸性气体的体积分数为________(精确到0.00001)。
(5)在上述操作步骤②中,若装置温度略有升高,实验结果______(填“偏大”、“不变”或“偏小”)。