向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: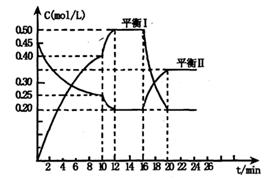
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子
(1)若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C三种元素的单质熔点由大到小的顺序是 (用化学式表示)。
(3)当n=2时,B位于元素周期表的 区,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|||||||||||||||||
| f |
y |
h |
i |
||||||||||||||
| b |
e |
j |
|||||||||||||||
| c |
d |
[ |
d |
g |
l |
||||||||||||
| [ |
|||||||||||||||||
(1)请写出上述元素d3+的核外电子排布式 ;
(2)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
(3)请写出e元素的原子价电子轨道表示式 ;
(4)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的原子轨道的杂化类型是 , g2+与ya3形成的g[ (ya3)4]2+离子的空间构型是四面体形,其中g2+离子提供4个能量最低的空轨道通过杂化与ya3形成 (填化学键类型)。
(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为 ,B的元素名称为 ;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为
(3)D元素的原子序数为33,该元素原子的核外电子共有 种不同的运动状态,此元素原子的核外电子排布式是 
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(5)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ·mol-1,H(g)=H+(g)+e-吸收的能量为1311kJ·mol-1,则氢负离子H-的第一电离能为
现有下列物质, 请用字母填空:
| A.干冰 | B.金刚石 | C.氦 | D.晶体硅 E.过氧化钠 F.二氧化硅 G.氯化铵 |
(1)属于原子晶体的化合物是 ,
(2)固态时不含化学键的分子晶体是 
(3)含有非极性键的离子化合物是 。
(4)含有离子键、共价键、配位键的化合物是 。
卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I),请预测下列物质的性质:
(1)熔点: F2Cl2(填“<”或“=”“或>”,下同),沸点:HFHCl,一定压强下HF和HCl的混合气体降温时(填HF或HCl)先液化。
(2)分解温度:HFHCl,熔点:NaFSiF4