下列离子方程式书写正确的是( )
| A.氢氧化钠溶液和稀盐酸反应:H++OH-===H2O |
| B.大理石与盐酸反应制取二氧化碳:CO32-+ 2H+===H2O + CO2↑ |
| C.铁粉投入FeCl3溶液中:Fe + Fe3+===2Fe2+ |
| D.用小苏打治疗胃酸过多:CO32-+ 2H+===CO2↑+H2O |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是 ()
A.CO2的电子式: |
B.质量数为37的氯原子: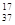 Cl Cl |
C.NH4Cl的电子式: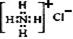 |
D.原子核内有10个中子的氧原子: |
有机物A的结构简式为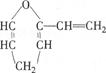 ,它的同分异构体中属于芳香族化合物的结构共有 ( )
,它的同分异构体中属于芳香族化合物的结构共有 ( )
| A.3种 | B.4种 | C.5种 | D.6种 |
下列离子方程式正确的是( )
A.尼泊金酸与碳酸氢钠反应:  |
B.醋酸溶液与新制氢氧化铜反应:  |
C.苯酚钠溶液中通入少量二氧化碳  |
D.甲醛溶液与足量的银氨溶液共热   |
在同温同压下,某有机物和过量的Na反应得到V1 L氢气,取另一份等量的有机物和足量的NaHCO3溶液反应得到V2 LCO2,若V1 L= V2L ≠ 0,则有机物可能是 ()
A.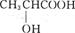 |
B.HOOC—COOH |
| C.HOCH2CH20H | D.CH3CH20H |
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )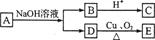
A.2种B.3种
C.4种D.5种