某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,
原因是 。
(2)哪一段时段的反应速率最小 ,原因是
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号) 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
制印刷电路的废液含有大量CuCl2、FeCl2和FeCl3,测得某废腐蚀液中含CuCl21.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验,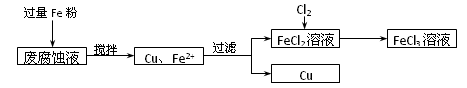
回答下列问题:
(1)用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________;检验废腐蚀液中含有存在Fe2+的方法是______________________(注明试剂、现象)。
(2)实验室可用浓盐酸和固体MnO2反应制备Cl2。此反应中体现了盐酸的_________性质,反应的离子方程式为____________________。
利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。请从图2中挑选所需的仪器,完成图1中的装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。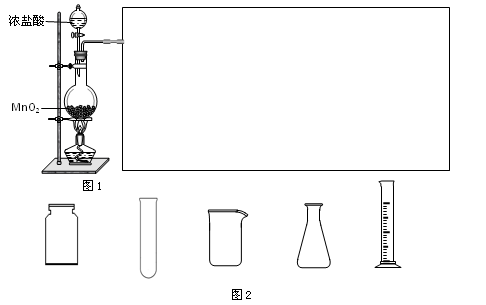
(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,需通入Cl2的物质的量不少于_______________mol。
一般情况下,当人体一次性摄取300 mg~500 mg亚硝酸钠时,就会引起中毒.某研究小组用碘量法测定泡菜中亚硝酸盐的含量.有关反应如下:
2NaNO2+2H2SO4+2KI===2NO↑+I2+K2SO4+Na2SO4+2H2O
2Na2S2O3+I2===Na2S4O6+2NaI
取1 kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使泡菜汁中的亚硝酸盐都成为亚硝酸钠.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1 L,取25.00 mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,再选用合适的指示剂,用0.05000 mol·L-1Na2S2O3标准溶液进行滴定.实验数据记录如下:
| 滴定次数 |
0.050 00 mol·L-1 Na2S2O3标准溶液体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
|
| 1 |
0.00 |
20.04 |
| 2 |
0.12 |
20.08 |
| 3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是________,滴定终点的现象是________.
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害.这主要是因为橙汁中含有丰富的维生素C,维生素C具有________性(填“氧化”或“还原”).
(3)通过计算判断若某人一次食入0.125 kg这种泡菜,是否会引起中毒?
________________________________________________________________________
________________________________________________________________________
请设计实验方案,用以证明某淀粉溶液,
①正在水解,②完全没有水解,③已经水解完全。
(12分)今年5月我区举行实验技能考查,某兴趣小组的同学在帮助老师准备化学实验时,发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。为了鉴定该试剂成分,同学们做了以下探究:
【提出问题】这瓶试剂的成分是什么?
[讨论]根据受损标签及实验室药品分类摆放的原则,这瓶试剂可能不是_______________________;
A.酸 B.碱 C.盐
[猜想]①可能是NaOH溶液;②可能是Na2CO3溶液;
③可能是_______________________(写一种)。
[探究活动]
(1)小军取少量试样于小试管中,滴加酚酞试液,溶液变为红色。由此小军认为猜想①正确。
经同学们交流讨论后,一致认为小军的方案不可行,理由是_______________________
(2)小华同学认为,虽然小军的实验不能得到正确的结论,但只要再往溶液中滴加一种氯化
物溶液,同样能得出正确的结论。
| 操作步骤 |
实验现象 |
实验结论 |
| 取少量滴有酚酞试液的试样于小试管中,滴加足量的___________ |
溶液由红色褪为无色 且有白色沉淀产生 |
猜想②正确 |
(3)小亮发现要进一步确定(1)中的成分,只需选择上图已有的试剂就能把它鉴定出来。于是他们进行了如下实验。
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取少量试样于小试管中,滴加适量的_______________________ |
_________________ _________________ |
猜想②正确 有关化学方程式 _________________ |
[实验反思]实验室盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是:NaOH与玻璃中的
SiO2发生反应,其化学方程式为2NaOH + SiO2=" X" + H2O,产物X使瓶口与塞子粘合在一起。
试推测X的化学式为_________________。
(14分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下: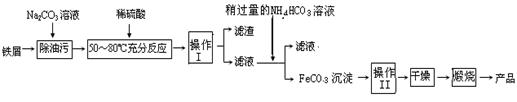
回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________。
②写出在空气中煅烧FeCO3的化学方程式;
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
a.称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_____________________________________________。
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)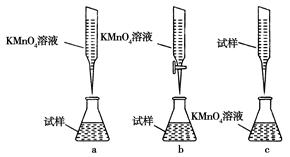
③计算上述样品中FeSO4·7H2O的质量分数为。