)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、
Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________。
(4)比较Y、Z气态氢化物的稳定性:________>____________。(用分子式表示)
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是_________>___________>____________>__________。
(6)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:_______ ______________。
A、B、C、D均为中学化学所学的常见物质,它们之间的转化关系如下列各图所示(部分反应条件或产物已略去).请按要求回答下列问题: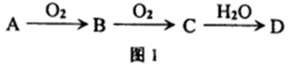
(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示:
①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是 ;用方程式表示A溶于水,使酚酞变红的原因: .
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为 、 .符合上述条件且含有离子键的C的电子式: .
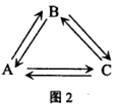
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示:
若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物。请用离子方程表示B溶液显碱性的原因: ;在实验室里,欲使A溶液中的阳离子全部沉淀出来转化为C,所发生化学反应的离子方程式为_____________。
有机合成(某课题组以苯为主要原料,采用以下路线合成利胆药-柳胺酚.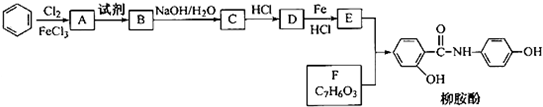
已知: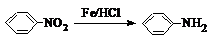 .请回答下列问题:
.请回答下列问题:
(1)对于柳胺酚,下列说法正确的是()
| A.1mol柳胺酚最多可以和2molNaOH反应 |
| B.不发生硝化反应 |
| C.可发生水解反应 |
| D.可与溴发生取代反应 |
(2)写出A→B反应所需的试剂____________________。
(3)写出B→C的化学方程式______________________。
(4)写出化合物F的结构简式_____________________。
(5)写出同时符合下列条件的F的同分异构体的结构简式____________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: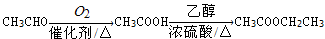 。
。
有机物A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
已知: (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量钠作用产生H2 22.4 L(标准状况),则F的分子式是__________________。
(2)G与F的相对分子质量之差为4,则G的性质是________(填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是_______________________
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式: _____________________。
(5)A转化为B和F的化学方程式是_________________________。
(6)某烃分子H的碳原子数小于10,核磁共振氢谱只有一组峰, 在相同条件下也可发生类似B → C的反应并只生成一种有机物I,I的结构简式: _______________。
化合物F是一种调香剂,结构为 ;以化合物A为原料合成F的工艺流程如下:
;以化合物A为原料合成F的工艺流程如下:
根据上述信息回答下列问题:
(1)化合物F不能发生的反应类型有 (填序号)。
| A.加成反应 | B.醋化反应 | C.水解反应 | D.加聚反应 |
(2)化合物A的结构简式为 ;分子中不同化学环境的氢核磁共振谱峰面积比为
(3)反应④的化学方程式为
(4)化合物F反式异构体结构简式为
已知有机物A是具有水果味的液体,其分子式为C4H8O2,在一定条件下有下列转化关系:
(1)写出A的结构简式__________________;
(2)由A与氢氧化钠溶液反应生成B和C属于____________反应(填反应类型);
(3)写出下列反应的化学方程式____________________
连续氧化中的第一步反应___________________________
C→CH3COOH_______________________________________
(4)A有多种同分异构体,写出符合下列条件的所有A的同分异构体的结构简式_________________。
①该有机物能与氢氧化钠反应 ②结构中只含一个甲基