下列热化学方程式正确的是(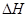 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |
现有物质的量浓度相同的7种溶液:(a)NaHSO4;(b)NaHCO3;(c)H2SO4;(d)Al2(SO4)3;(e)Na2CO3;(f)Na2SO4;(g)Ba(OH)2;pH由小到大的顺序为()
| A.(c)(a)(b)(d)(f)(e)(g) | B.(c)(a)(d)(f)(b)(e)(g) |
| C.(g)(e)(b)(f)(d)(a)(c) | D.(c)(a)(d)(f)(e)(b)(g) |
将体积都为10 mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和bmL,则得稀释后溶液的pH均为5。则稀释后溶液的体积
| A.a=b=100mL | B.a =b=1000mL | C.a <b | D.a >b |
反应2SO2+O2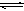 2SO3,经一段时间后SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.4mol·L-1·s-1 ,则这段时间为()
2SO3,经一段时间后SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.4mol·L-1·s-1 ,则这段时间为()
| A.0.1s | B.2.5s | C.0.5s | D.10s |
在H2S的饱和溶液中存在下列平衡 ①H2S H++HS-②HS-
H++HS-②HS- H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是()
H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是()
| A.加NaOH | B.通入H2S气体 |
| C.降温 | D.加入Na2S晶体 |
反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是()
A低温下自发进行,高温下非自发进行
B高温下自发进行,低温下非自发进行
C任何温度下均为非自发进行
D任何温度下均为自发进行