铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼胶KNO3的U形管)构成一个原电池,如图: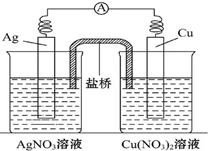
以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-====Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
合成氨反应的正反应是气体体积减小的放热反应。合成氨工业的生产流程如下: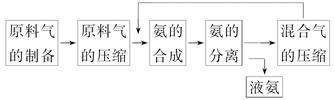
关于合成氨工业的说法中不正确的是( )
| A.混合气进行循环利用遵循绿色化学思想 |
| B.合成氨反应须在低温下进行 |
| C.对原料气进行压缩是为了增大原料气的转化率 |
| D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
已知200 ℃,反应2NO(g)+2CO(g) 2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )
2CO2(g)+N2(g)的平衡常数K=10,则下列情况达到平衡状态的是( )
| c(NO) |
c(CO) |
c(CO2) |
c(N2) |
|
| A |
1 |
1 |
0.1 |
0.1 |
| B |
0.1 |
0.1 |
0.1 |
0.1 |
| C |
0.2 |
0.1 |
0.2 |
1 |
| D |
0.3 |
0.2 |
0.2 |
0.3 |
下列反应在任意温度下一定能自发进行的是( )
A.2NaCl+2H2O 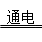 2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑ |
| B.NH3(g)+HCl(g)=NH4Cl(s) ΔH<0 |
| C.CaCO3(s)=CaO(s)+CO2(g) ΔH>0 |
| D.X2Y2(g)=X2(g)+Y2(g) ΔH<0 |
高温下,某反应达平衡,平衡常数K=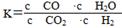 ,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O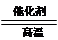 CO2+H2 CO2+H2 |
[双选题]可逆反应2A(g)+B(g) 3C(?)+D(?) ΔH<0,其他条件不变,随着温度的降低,混合气体平均相对分子质量有变小的趋势,则下列判断正确的是( )
3C(?)+D(?) ΔH<0,其他条件不变,随着温度的降低,混合气体平均相对分子质量有变小的趋势,则下列判断正确的是( )
| A.C和D可能都是固体 |
| B.C和D一定都是气体 |
| C.若D为固体,则C一定是气体 |
| D.C和D可能都是气体 |