下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。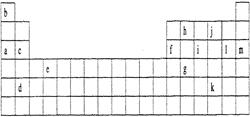
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| |
锂 |
X |
Y |
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7296 |
4570 |
1820 |
| 失去第三个电子 |
11799 |
6920 |
2750 |
| 失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中的X可能为以上13种元素中的 (用字母序号填写)元素,这种元素和j形成的化合物中若存在共价键,则该化合物的电子式是 ,这种物质属于 (填“离子”或“共价”)化合物。
③Y在周期表中是 族的元素。
④在以上13种元素中, (用字母序号填写)元素原子失去核外第一个电子需要的能量最多。
元素周期表前7周期的元素如表所示:
| 周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第6,7周期比第4,5周期多了14种元素,原因是。
(2)周期表中族所含元素最多,族元素形成化合物最多。
(3)请分析周期数与元素数的关系,然后预言第8周期最多可能含元素种数为()。
A.18B.32C.50D.64
(4)居里夫人发现镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是()。
A.在化合物中呈+2价B.氢氧化物呈两性
C.单质使水分解,放出氧气D.碳酸盐难溶于水
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
| 甲 |
乙 |
丙 |
丁 |
|
| 化合物中各元素原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多两个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)试推断出各元素的符号:A;B;C;D;E。
(2)E元素位于周期表中第周期族,其最简单离子的结构示意图为,E的最高化合价为_____价。
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是____(元素符号),并写出反应的离子方程式:_________________、_________________。
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有()。
| A.1对 | B.2对 | C.3对 | D.4对 |
下图是我们熟悉的元素周期表,请回答下列问题:
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)在上面元素周期表中全部是金属元素的区域为(填序号)。
| A.A | B.B | C.C | D.D |
(3)①写出表示含有8个质子、10个中子的原子的化学符号:。
②周期表中位于第8纵行的铁元素属于第族。
③周期表中最活泼的非金属元素位于第纵行。
④所含元素超过18种的周期是第、周期。
(4)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的族。
下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 第2周期 |
⑥ |
⑦ |
||||||
| 第3周期 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 第4周期 |
② |
④ |
⑨ |
(1)10种元素中,化学性质最不活泼的是________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____。
(4)元素⑦的氢化物的化学式为________;该氢化物常温下和元素⑧的单质反应的化学方程式为______________________。
(5)①和⑨两种元素形成化合物的化学式为______,该化合物燃烧时的焰色为______,该化合物溶液与元素⑧的单质反应的化学方程式为________________。