下列离子方程式书写正确的是
A.NaHS水解反应:HS-+ H2O   H3O++ S2- H3O++ S2- |
B.明矾加入在水中起净化作用的原因:Al3++ 3H2O 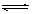 Al(OH)3(胶体) + 3H+ Al(OH)3(胶体) + 3H+ |
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO 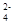 +H++OH-===BaSO4↓+H2O +H++OH-===BaSO4↓+H2O |
| D.碳酸氢钠溶液中加入过量Ba(OH)2溶液: |
2HCO3- + Ba2+ + 2OH-= BaCO3↓+ CO32-+ 2H2O
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是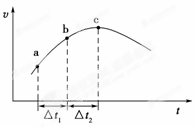
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)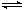 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是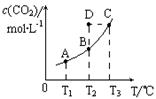
A.反应CO(g)+H2O(g)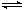 CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.由D状态转变为C状态后,混合气体的平均相对分子质量不变 |
把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)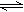 xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
| A.5min内P的平均反应速率为0.15mol/(L·min) | B.Q的平衡浓度为1mol/L |
| C.Q的转化率为25% | D.x是2 |
如下图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
| A.减小 | B.增大 | C.不变 | D.无法确定 |
有两个极易导热的密闭容器a和b(如图所示),a容器体积恒定,b容器压强恒定。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2 N2O4△H<0,则以下说法正确的是
N2O4△H<0,则以下说法正确的是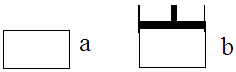
| A.反应起始时两容器的反应速率va和vb的关系:va<vb |
| B.反应过程中两容器内的反应速率va和vb的关系:va<vb |
| C.反应达到平衡时,两容器内压强相同 |
| D.反应达到平衡时,两容器的NO2的转化率相同 |