铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)= Na3AlH6 (s)+
Na3AlH6 (s)+ 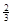 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) +  H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) + H2(g) ΔH= 。
H2(g) ΔH= 。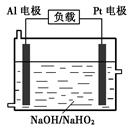
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去。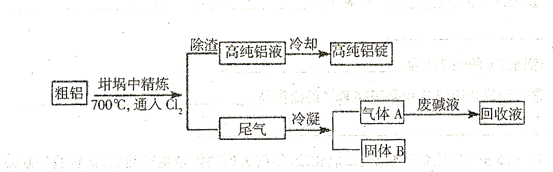
(注:NaCl熔点为801℃;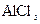 在181℃升华)
在181℃升华)
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①
精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和②。
和②。
(2)将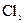 连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除
连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除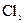 外还含有,固态杂质粘附于气泡上,在熔体表面形定浮渣,浮渣中肯定存在。
外还含有,固态杂质粘附于气泡上,在熔体表面形定浮渣,浮渣中肯定存在。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为
。
实验室以食盐、二氧化碳、氨气为原料模拟生产纯碱,该实验先制得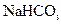 ,进而制取纯碱。主要装置如下:
,进而制取纯碱。主要装置如下: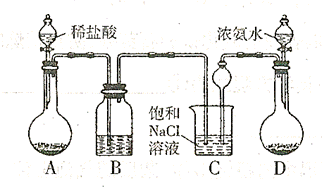
请回答下列问题:
(1)A中发生反应的离子方程式为;B中所盛的溶液为
。
(2)D装置用来产生 ,则固体D可以是(只填一种;C装置中球形漏斗的作用是 。
,则固体D可以是(只填一种;C装置中球形漏斗的作用是 。
(3)向C中通人气体时,应先通,理由是
。C中反应的总的化学方程式为
。
(4)C中分离出的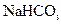 晶体可能含有的杂质有,用该
晶体可能含有的杂质有,用该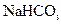 晶体制取纯碱时,有的杂质不会影响纯碱的纯度。原因是
晶体制取纯碱时,有的杂质不会影响纯碱的纯度。原因是
(用化学方程表示)。
(5)写出用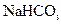 制取纯碱的化学方程式。
制取纯碱的化学方程式。
铁及铁的化合物应用广泛,如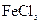 可用作印刷电路铜板腐蚀剂。
可用作印刷电路铜板腐蚀剂。
(1)写出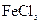 溶液腐蚀印刷电路铜板的离子方程式。
溶液腐蚀印刷电路铜板的离子方程式。
腐蚀铜板后的混合溶液中,若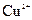 、
、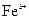 的浓度均为
的浓度均为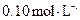 ,不考虑溶液体积的变化,则原
,不考虑溶液体积的变化,则原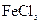 溶液的浓度为。
溶液的浓度为。
(2)某化学小组在实验室按照下列操作分离腐蚀铜板后的混合液并制取有关物质,图示如下:
请回答下列问题:
①试剂X为;试剂Y为;操作M为
。
②固体c的化学式为。
③检验混合溶液B中是否存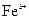 的操作是
的操作是
。
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。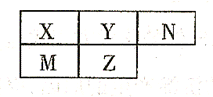
请回答下列问题:
(1)元素X位于周期表中第周期,族;
(2)这些元素的氢化物中,稳定性最强的是(写化学式);
(3)Y与N形成的化合物中,Y可能的化合价有;
(4)M、Z的原子半径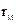
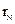 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
(2)将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
(3)同温同压下,气体A与氧气的质量比为1∶2,体积比为1∶4,气体A的相对分子质量是