在一定体积密闭容器中,进行如下反应:
CO2(g) + H2(g)  CO(g) + H2O(g),
CO(g) + H2O(g),
其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1) K的表达式为:
(2) 该反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否达到化学平衡状态的依据
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4)在830℃时,若起始浓度c(CO)为1mol·L—1,c(H2O)为1mol·L—1,反应达到平衡时,CO的转化率为 。
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均相对分子质量不变
D.密闭容器中气体密度不变
(2)根据表中数据,列式计算15.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为
;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为
;
理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右所示(写出最佳答案)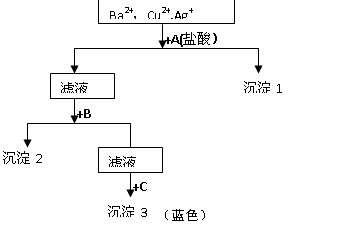
(1).写出沉淀的化学式:
沉淀1,沉淀2,沉淀3;
(2).写出混合液+A的离子方程式:。
滤液+B的离子方程式:。
在反应SO2 + Cl2 + 2H2O =" 2HCl" + H2SO4中,氧化剂是:______,
还原剂是:_______________,被氧化的物质是:________,发生还原反应的物质是:___________.当有1mol的HCl生成时,反应中转移的电子数是:__________mol,参加反应的SO2的质量_________克.
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的氧化产物为______________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: ________________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为。(假设溶液体积不变)