25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是
A. pH=2的HA溶液与pH=12的MOH溶液以任意比混合c(H+) + c(M+)=c(OH-) + c(A-)
B. Na2CO3溶液:c(OH-)=c(HCO-3)+c(H+)+2c(H2CO3)
C. 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:
c(Na+)= c(CHCOO-)> c(H+)= c(OH-)
D. pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
下列各组离子,一定能大量共存的是:
| A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、Cl-、HCO3-、Na+ |
| B.含有大量Fe3+的溶液:Na+、HCO3-、NO3-、CO32- |
| C.加入铝粉能产生氢气的溶液:NH4+、Fe2+、SO42-、Cl- |
| D.pH试纸变深红色的溶液中:NH4+、Ca2+ 、Cl-、K+ |
关于如图所示装置的叙述,正确的是()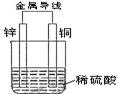
| A.铜是负极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
含n g硝酸的稀溶液恰好和m g铁粉完全反应若有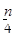 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能
| A.1:1 | B.2:1 | C.3:1 | D.9:2 |
下列物质中,不属于电解质的是:
| A.乙醇 | B.CH3COOH | C.BaCl2 | D.Cl2 |
下列反应的离子方程式正确的是()
| A.氯气通入氢氧化钠溶液中 Cl2 +2OH― = Cl― + ClO― + H2O |
| B.金属铁与稀硝酸反应 Fe + 2H+ = Fe2+ + H2↑ |
| C.在硅酸钠溶液中滴加稀硫酸 SiO32― + 2H+ = H2SO3↓ |
| D.铜粉与98.3%的硫酸加热下反应 Cu + 4H+ + SO42― = Cu2+ + SO2↑ + 2H2O |