常温下,有四种溶液:
| ① |
② |
③ |
④ |
⑤ |
| 0.001mol·L-1 CH3COOH溶液 |
pH=10 NaOH溶液 |
0.001mol·L-1 NaOH溶液 |
pH=4 CH3COOH溶液 |
pH=4 NH4Cl溶液 |
回答下列问题:
(1)①稀释到原来的10倍后的溶液pH ④溶液的pH。 (填“>”或“=”或“<”等,下同)。
(2)④和⑤两溶液中水电离出的c(H+):④ ⑤。
(3)①与③混合,若溶液pH=7,则两溶液体积关系为V(NaOH) ______V(CH3COOH)。
(4)②与④等体积混合,则溶液pH 7,其所得溶液中的溶质组成可能为: 。
A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素,已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又如A、C两元素原子序数之和是B、D两元素原子序数之和的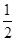 。 请回答下列问题
。 请回答下列问题
(1)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:_______,其晶体中所含化学键的类型有________。
(2)A2B与A2D的沸点:A2B________A2D(填“高于”或“低于”),其原因是_________________。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:________________。
(4)碳元素的一种同位素可测定文物年代,这种同位素的符号是_______。H2O2的化合物类型是_____(填“共价化合物”或“离子化合物”)。
(1~4小题每空2分,5~6小题每空3分,共14分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)不能够发生加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是 (填字母)。
(5)写出实验室制C的化学方程式______________________。
(6)写出F发生溴代反应的化学方程式_________________。
I.在500 ℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
(1)在500 ℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_____(填“<”“>”或“=”)46.2 kJ,理由是_____________。
(2)将一定量的H2(g)和N2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。则该条件下达到平衡时H2的转化率为________。该温度下的平衡常数K的值为________。若升高温度,K值________(填“增大”“减小”或“不变”)。
II.一定条件下,某容积为1L的密闭容器中发生如下反应:C(s) + H2O(g) CO(g) + H2(g)
CO(g) + H2(g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为 。
(2)在(1)中若起始时充入的是2.5 molCO(g)和4molH2(g),达到平衡后混合气体的平均相对分子质量为 。
有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 |
元素性质与原子(或分子)结构 |
| T |
最外层电子数是次外层电子数的3倍 |
| X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y |
M层比K层少1个电子 |
| Z |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图:_____________________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示)。下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z强
(3)写出T与Y形成的化合物的化学式_______________,________________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:__________________。
如图是某同学设计的一个简易的原电池装置,回答下列问题。
(1)若a为镁、b为CuCl2,则正极材料为_____,负极上的电极反应式为_________。
(2)若a为镁、b为NaOH,则Mg极上发生________反应(填“氧化”或“还原”),负极上的电极反应式为_______________。
(3)若a为铜、b为浓硝酸,则电流的方向为____→___(填电极材料),正极上的电极反应式为______。
(4)上述事实表明,确定原电池中电极的正负时,不仅要考虑电极材料本身的性质,还要考虑________。