巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是
| A.只有②④⑤ | B.只有①③④ | C.只有①②③④ | D.全部 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
对某一可逆反应来说,使用催化剂的作用是
| A.提高反应物的平衡转化率 |
| B.以同样程度改变正逆反应的速率 |
| C.增大正反应速率,减小逆反应速率 |
| D.改变平衡混合物的组成 |
设C+CO2 2CO-Q1,反应速率为v1;N2+3H2
2CO-Q1,反应速率为v1;N2+3H2 2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3+Q2,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则平均每秒钟浓度变化正确的是
| A.NO:0.001 mol·L-1 | B.H2O:0.002 mol·L-1 |
| C.NH3:0.002 mol·L-1 | D.O2:0.00125 mol·L-1 |
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率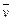 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.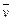 (NH3)=0.010 mol·L-1·s-1 (NH3)=0.010 mol·L-1·s-1 |
B.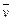 (O2)=0.0010 mol·L-1·s-1 (O2)=0.0010 mol·L-1·s-1 |
C.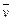 (NO)=0.0010 mol·L-1·s-1 (NO)=0.0010 mol·L-1·s-1 |
D.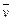 (H2O)=0.045 mol·L-1·s-1 (H2O)=0.045 mol·L-1·s-1 |