0.1mol/L的NH4Cl溶液中,离子浓度大小排列正确的是
| A.c(Cl-)> c(NH4+)> c(OH-)> c(H+) |
| B.c(NH4+)> c(Cl-)> c(OH-)> c(H+) |
| C.c(Cl-)> c(NH4+)> c(H+)> c(OH-) |
| D.c(NH4+)> c(Cl-)> c(H+)> c(OH-) |
下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:Al3+ 、NH4+ 、Cl- 、HS- |
| B.水电离出的C(H+)=1×10-13 mol.L-1的溶液中:Ca2+ 、HCO3- 、I- 、NO3- |
| C.弱酸性溶液中:Na+ 、NH4+ 、HSO3- 、Cl- |
| D.漂白粉的水溶液中:Fe2+ 、SO42-、 Mg2+、 Na+ |
探究铜和浓硫酸的反应,下列装置或操作错误的是
| A.上下移动装置甲中的铜丝可控制生成SO2的量 |
| B.装置乙可用于收集SO2气体 |
| C.为确认CuSO4生成,将试管中的液体倒入装置丙中稀释,观察颜色 |
| D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4 .5H2O |
已知下列转化关系中,甲、乙均为单质,下列判断正确的是
甲+乙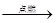 丙
丙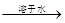 丙溶液
丙溶液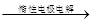 甲+乙
甲+乙
| A.甲可能是钠 | B.乙可能是氢气 |
| C.丙可能是氧化铝 | D.丙可能是三氧化硫 |
根据下表的信息判断,下列说法错误的是
| 序号 |
反应物 |
产物 |
| ① |
Cl2 、 H2O2 |
Cl- |
| ② |
Cl2、FeI2 |
FeCl2、I2 |
| ③ |
KClO3、HCl |
Cl2、KCl 、H2O |
A.第①组反应的氧化产物为O2
B.第②组反应中Cl2和FeI2的物质的量之比小于或等于1:1
C.第③组反应中生成1molCl2转移6mol电子
D.氧化性由强到弱的顺序为ClO3->Cl2 >I2
下列现象或事实可以用同一原理解释的是
| A.浓硫酸和浓盐酸长期露置在空气中浓度均降低 |
| B.氯化铵和碘都可以用加热的方法进行提纯 |
| C.氯水、SO2均能使品红溶液褪色 |
| D.溴蒸汽和NO2气体都能使湿润的淀粉碘化钾试纸变蓝 |