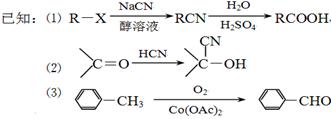
以标准的盐酸滴定未知浓度的氢氧化钠为例,判断以下操作所引起的误差(填“偏大”“偏小”或“不变”)。
(1)读数:滴定前俯视或滴定后仰视 ( )
(2)未用标准液润洗酸式滴定管 ( )
(3)用待测液润洗锥形瓶 ( )
(4)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ( )
(5)移液管吸取待测液后,悬空放入锥形瓶,少量待测液洒在瓶外 ( )
(6)碱式滴定管(量待测液用)或移液管用蒸馏水洗净后直接注入待测液 ( )
(7)滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出 ( )
(8)开始时标准液在滴定管刻度线以上,未予调整 ( )
(9)锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液 ( )
(10)滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁 ( )
现用如下方法合成高效、低毒农药杀灭菊酯(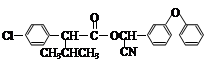 ) :
) :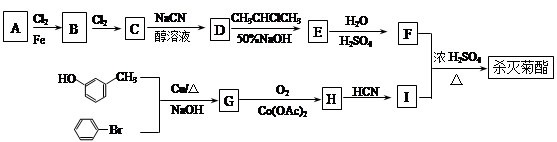
(1)按照系统命名法命名,B的名称是_____________;合成G的反应类型是__________。
(2)有关A的下列说法正确的是__________(填序号)。
a.A与苯互为同系物
b.A的核磁共振氢谱有5个峰
c.充分燃烧等物质的量A和环己烷消耗氧气的量相等
d.A的所有原子可能处在同一平面上
e.A不能使酸性KMnO4溶液褪色
(3)写出反应 F+I→杀灭菊酯的化学方程式:___________________。
(4)写出C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
______________
(5)D在硫酸存在下发生水解生成J:D 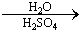 J
J
写出符合下列要求的J的所有同分异构体的结构简式:_。
①苯环上有两个位于间位的取代基;②能水解成两种有机物;③可以银镜反应。
(6)X与F互为同分异构体,X苯环上有三个取代基且含有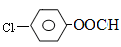 结构,则符合此条件的F共有种。
结构,则符合此条件的F共有种。
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=_____。
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。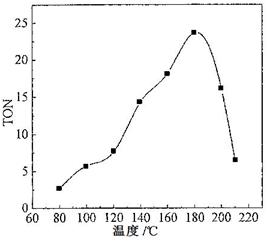
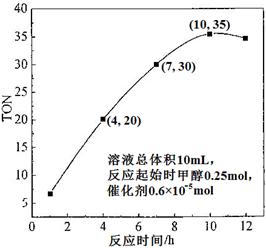
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(下图),判断下列说法正确的是_____。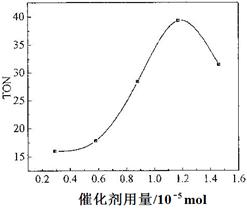
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式:,Cr2O72-转化为毒性较低的Cr3+的离子方程式为:。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴溶液为指示剂,滴定的终点现象为。
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:
(1)操作Ⅱ的名称是____________。
(2)可循环利用的物质____________(填化学式)。
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。
(4)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
A.稀盐酸B.稀硫酸C.稀醋酸
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)
(14分)塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂。增塑剂 DEHP(C24H38O4)可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子。
已知:
回答下列问题:
(1)E的结构简式是______。
(2)B→C的反应类型是____________
(3)3—甲基庚烷的某同分异构体核磁共振氢谱显示只有一种氢,写出该同分异构体的结构简式并命名:
①结构简式____________
②命名____________
(4)DEHP的结构简式是____________
(5)F是E的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液呈紫色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式:____________________________________