已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
元素A、B、C、D、E、F原子序数依次增大,且都为短周期元素。A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物的电子为,
该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式。
(2)将化合物EC2通入只含有 n mol化合物D2E的溶液中,充分反应后,溶液出现浑浊,则该化合物D2E的溶液最多能吸收化合物EC2的物质的量为(不考虑水中溶解的化合物EC2)
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的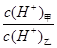 =;乙溶液中所含离子的物质的量浓度由大到小的顺序是。
=;乙溶液中所含离子的物质的量浓度由大到小的顺序是。
(4)电解由A与F形成化合物的溶液时,若阴、阳极都用石墨作电极,则阴极发生反应(填“氧化”、“还原”),阳极的电极反应式为。
【化学—选修3:物质结构与性质】已知位于元素周期表前四周期的六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为_______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________
在该晶体中,E4+的氧配为数为___________。若该晶胞边长为a nm可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)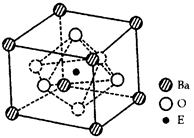
蛇文石矿可以看作是由MgO、Fe2O3、Al2O3、SiO2组成。由蛇文石制取碱式碳酸镁的实验步骤如下: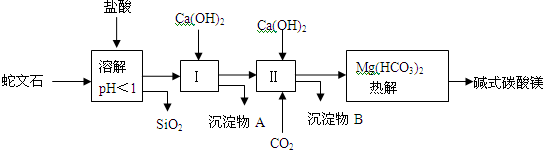
(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.3 |
9.6 |
Ca(OH)2不能过量,若Ca(OH)2过量会导致溶解、生成沉淀。
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入(填物质的化学式),然后(依次填写实验操作名称)。
(4)物质循环使用可节约能源。上述实验中,可以循环使用的物质是(填写物质的名称)。
(5)设计一个实验,确定产品a MgCO3·b Mg(OH)2·cH2O中的a、b、c的值。将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO。由此可知,产品的化学式中a∶b∶c=。(填最简整数比)
本题为《化学反应原理(选修4)》模块选做题,每空2分,共20分。
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量。则表示H2燃烧热的热化学方程式是()
A.H2(g) +1/2 O2(g)=H2O(g)ΔH =+285.8 kJ/mol
B.H2(g) +1/2 O2(g)=H2O(l)ΔH =-285.8 kJ/mol
C.H2(g) +1/2 O2(g)=H2O(l)ΔH =+285.8 kJ/mol
D.H2 +1/2 O2 =H2OΔH =-285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是(填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol
2NH3(g)ΔH=-92.4 kJ/mol
反应达到平衡后,升高温度则反应速率(填“增大”或“减小”);平衡将向(填“正反应方向”或“逆反应方向”)移动。
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C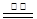 Zn+CO↑,此法属 (填选项字母代号)。
Zn+CO↑,此法属 (填选项字母代号)。
A.电解法 B.热还原法 C.热分解法
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液 (B)0.1mol/LNH4Cl溶液
①溶液(A)的pH 7(填“>”、“<”或“=”);
②溶液(B)呈性(填“酸”、“碱”或“中”),升高温度可以(填“促进”或“抑制”)NH4Cl的水解。
本题为《化学与生活(选修1)》模块选做题,每空2分,共20分。
人类的衣食住行都离不开化学,化学与生活密切相关。
(1)根据要求,选择恰当的选项用字母代号填空:
①“含氟牙膏”中的氟应理解为。
A.单质 B.元素 C.离子
②为适应低碳生活,上学或上班最好。
A.乘私家车 B.乘公交车
③糖类、油脂、蛋白质、无机盐、水、维生素是人类不可缺乏的营养物质。
下列维生素中,可用于防治坏血病的是。
A.维生素A B.维生素B1 C.维生素C
④抗生素药有阻止多种细菌生长的功能,下列药物属于抗生素药的是。
A.阿司匹林B.青霉素C.抗酸药(氢氧化铝)
⑤下列方法不属于目前常用的垃圾处理方法的是。
A.焚烧法 B.干馏法C.堆肥法
(2)在全球每年被腐蚀的钢铁中,电化学腐蚀比化学腐蚀所占比例(填“高”或“低”)。
(3)下表所列的一些物质都是家庭常用物质,请根据实验要求,选择合适的化学试剂,将其字母代号填入对应的空格中。
| 实验要求 |
化学试剂 |
供选择的化学试剂 |
| 检验味精中是否含有食盐 |
A.新制氢氧化铜悬浊液 B.硝酸银溶液和稀硝酸 C.碘水 D.碳酸钠粉末 |
|
| 检验地瓜粉中是否含有淀粉 |
||
| 检验食醋中是否含有乙酸 |
||
| 区别蔗糖和葡萄糖 |