在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为________________。已知25 ℃时Ksp[Mg(OH)2] = 1.8×10-11,Ksp[Cu(OH)2] = 2.2×10-20。
化合物SOCl2是一种液态 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCL2和水反应的化学方程式 __.
__.
(2)AlCl3溶液蒸干灼 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 ____________________________________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 ____________________________________________.
由短周期元素组成的 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(1)A和B的混合物溶于水发生反应的离子方程式______________________________.
(2)B、E两溶液混合反应时,可观察到的现象是__________________________,写出其反应的离子方程式__________________________________________________.
铝土矿的主要成分为Al2O3。生产铵明矾[NH4Al(SO4)2·12H2O]和Z(其水溶液可用于伤口消毒)的工艺流程图如下: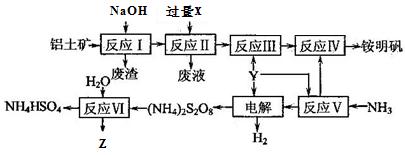
(1)反应Ⅰ的主要离子方程式是__________________________。
(2)已知反应Ⅱ中会生成氢氧化铝沉淀,则加入过量的X为_________(填化学式)。
(3)“电解”时,用惰性材料作电极,则阴极反应可表示为 _________。
(4)流程中可以循环使用的物质是。
(5)反应Ⅵ的化学方程式为 __________,其中的还原剂是____________。
(6)已知铵明矾的许多用途和明矾类似,请说明铵明矾的净水原理_________________________ 。
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)△H1=" —330.0" kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l)△H1=" —330.0" kJ·mol-1
第2步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)△H2="+226.3" kJ·mol-1
H2O(l)+H2NCONH2(l)△H2="+226.3" kJ·mol-1
(1)写出工业合成尿素的热化学方程式:
(2)下列措施中有利于提高尿素的产率的是___________。
| A.采用高温 | B.采用高压 | C.添加高效催化剂 | D.定时分离尿素 |
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示: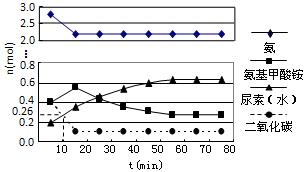
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)=。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g)  2NH3(g)△H = —92.4 kJ/mol
2NH3(g)△H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)
龙胆酸甲酯是制取抗心律失常药物——氟卡尼的中间体。
I、已知龙胆酸甲酯结构如图所示。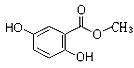
(1)龙胆酸甲酯的分子式为,它的含氧官能团名称为。
(2)下列有关龙胆酸甲酯的描述,不正确的是(填字母)。
| A.不能发生消去反应 | B.难溶于水 |
| C.能与溴水反应 | D.能与碳酸钠溶液反应产生二氧化碳 |
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式是
。(不用写反应条件)
II、已知X及其他几种有机物存在如下转化关系,且测得转化过程中的C4H8为纯净物: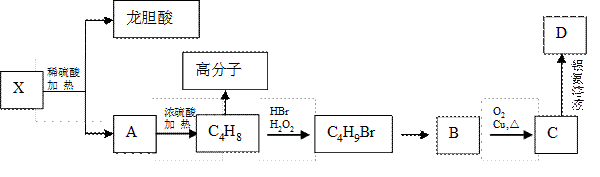
回答以下问题:
(4)写出满足下列条件的龙胆酸的一种同分异构体的结构简式
①能发生银镜反应;②能使FeCl3溶液显色;③酯类。
(5)写出B生成C的化学方程式,它的反应类型是
反应。