用下图所示装实验置进行铜与浓硫酸反应的实验探究,请回答下列问题: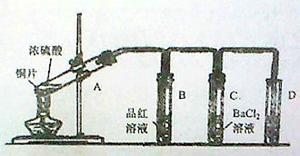
(1)试管A中发生反应的化学方程式为 。
(2)试管B中的实验现象是 ,将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是 。
(3)反应一段时间后,试管C中没有观察到沉淀生成,若往试管C中通入或加入一种物质X,即生成白色沉淀,该物质X不可能是下列的 。(填序号)
a、 b、
b、 c、
c、 d、
d、
(4)试管A中的铜和硫酸充分反应后,铜和硫酸都有剩余,下列物质中能使试管A中的铜片继续溶解的是 。(填序号)
a、 b、
b、 c、
c、 d、
d、
(5)试管D中的试剂是 溶液,其作用是 。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。请回答下列问题: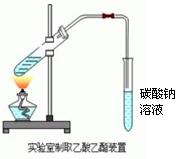
(1)被加热试管中盛放的是乙醇和、(3 分),制取乙酸乙酯的化学方程式为:。
分),制取乙酸乙酯的化学方程式为:。
(2)浓硫酸的作用是和吸水剂;
(3)饱和碳酸钠溶液的主要作用是: 。
。
(4)装置中通蒸汽的导管要插在饱和碳酸钠溶液的液面之上,不能插入溶液中,目的是防止。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是。
硫化钠和碳酸钠为原料、采用下述装置制备硫代硫酸钠,制备反应可表示为:
2Na2 S +Na2CO3 + 4SO2 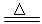 3Na2S2O3 +CO2。根据要求回答问题:
3Na2S2O3 +CO2。根据要求回答问题:
(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是。
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH。
①反应过程中,锥形瓶中溶液pH将________(填“增大”、“减小”或“保持不变”)。
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是。
③若实验过程中测得溶液pH已接近于7。此时应该进行的操作是。
(3)已知:2Na2 S2O3 +I2="2NaI+" Na2 S4O6。实验结束后进行相关处理,可即获得Na2 S2O3 ·5H2O晶体。为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是。
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取。为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
| 实验序号 |
溶液pH |
亚硫酸钠与水的质量比 |
反应温度 |
硫粉质量 |
亚硫酸钠转化率 |
| 1 |
10 |
1.5:1 |
100 |
18 |
80.7% |
| 2 |
a |
1.1:1 |
100 |
18 |
94.6% |
①实验1、2的目的是探究亚硫酸钠浓度对亚硫酸钠转化率的影响,则a=
②若还要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,除实验1、2外,至少还需进行次对比实验
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响。为什么?
答:___________________________________________。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。实验中从海藻提取碘的流程图如下: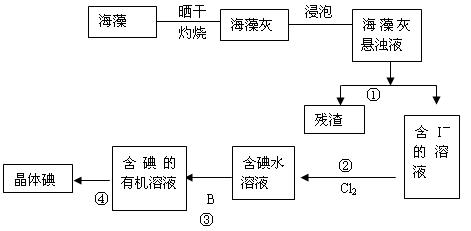
(1)指出提取碘的过程中有关的实验操作名称①写出过程②中有关反应的离子方程式:
(2)提取碘的过程③中可选择的有机试剂为
| A.酒精、四氯化碳 | B.四氯化碳、苯 |
| C.汽油、醋酸 | D.汽油、甘油 |
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
______________________________________________________________。
(4)在过程④的操作中发现晶体碘大量附着在烧瓶内壁上,是由于碘具有性质
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应只生成CuSO3一种沉淀;
乙同学认为这两溶液能相互促进水解,生成气体和Cu(OH)2一种沉淀;
丙同学认为同时生成CuCO3和Cu(OH)2两种沉淀。(已知:CuCO3和Cu(OH)2均不带结晶水)
I(1)写出Na2CO3溶液水解的离 子方程式;
子方程式;
(2)在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为:(填操作名称)、干燥。
Ⅱ.请用右图所示装髓,选择必要的试剂,进行定性探究生成物的成分。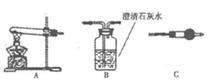
(1)各装置连接顺序为→→
→ 。
。
(2)装置C中装有试剂的名称是。
(3)能证明生成物中有CuCO3的实验现象是。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列装置的连接,进行定量分析来测定其组成。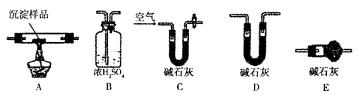
(1)装置c中碱石灰的作用是
(2)实验开始时和实验结束时都要通人处理过的过量空气,其作用分别是: 。
。
(3)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3岛的质量分数为×100%。
某研究性学习小组为了研究醋酸的电离情况,进行了如下探究。
实验一配制并标定醋酸溶液的浓度
用冰醋酸配制250 mol·L-1的醋酸溶液,再用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液。
(1)配制此醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、和。
(2)为了标定所配制醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.04 |
20.00 |
18.80 |
19.96 |
则 该醋酸溶液的准确浓度为。(保留四位有效数字)
该醋酸溶液的准确浓度为。(保留四位有效数字)
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1 ) ) |
0.001 |
0.01 |
0.02 |
0.1 |
0.2 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:。
(4)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度将。(填增大、减小或不变)
实验三探究温度对醋酸电离程度的影响
(5)请你设计一个实验方案完成该实验,简述实验的方案:。