下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):
______________________________________________________ __________________
_________________________________________ _______________________________。
(2)试管C中苯的作用是_________;反应开始后,观察D和E试管,看到的现象为:D中:__ __________________________ _________ ;
E中:___________________________ ______。(各2分)
(3)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是
________________________________________________________________________。
(4)在上述整套装置中,具有防倒吸的仪器有________(填字母)。(4分,错选无分)
(5)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是:
________________________________________________________________________。
如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl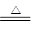 NH4NO2+NaCl
NH4NO2+NaCl
②NH4NO2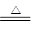 NH3↑+HNO2
NH3↑+HNO2
③2HNO2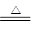 N2O3↑+H2O
N2O3↑+H2O
④2NH3+N2O3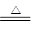 2N2+3H2O
2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
| N2和H2的体积比 |
5∶1 |
3∶1 |
1∶1 |
1∶3 |
1∶5 |
| 酚酞变红色所需时间/min |
8~9 |
7~8 |
6~7 |
3~4 |
9~10 |
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式________________________。
(2)铁粉撒在石棉绒上的目的是_________________________________
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是________________________。
请你另设计一个简单的实验验证你的理由____________________。欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和________之间。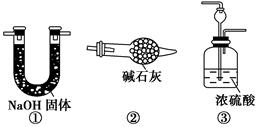
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为________比较适宜;但该装置还难以实现此目的,原因是______________________________________。
(5)实验过程中通入试管C中的气体成分有________。
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
查阅资料:资料表明,谷氨酸钠的存在不影响NaCl含量的测定。
设计实验方案:
(1)实验原理:____________________________________________________。
(2)实验试剂:水、试剂X的溶液等。
(3)实验过程:(如图所示)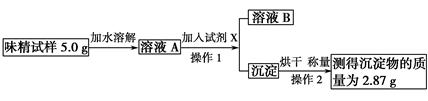
根据上述实验步骤回答下列有关问题:
操作1所需要的玻璃仪器有______________________________________;
用简明扼要的语言描述操作2的过程:_____________________________________________;
通过计算判断该味精中NaCl的质量分数是否符合其包装上标注的标准:
__________________________________________________________________
_________________________________________________________________;
加水溶解所得溶液A为50 mL,则溶液A中NaCl的物质的量浓度是
__________________________________________________________________
________________________________________________________________。
如图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g氢氧化钠,5 mL水和10 mL酒精。加入酒精的作用是_________________________________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得到的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为________________。
(4)图中长玻璃导管的作用为_______________________________________。
(5)写出该反应的化学方程式______________________________________。
糖原[(C6H10O5)n]是一种相对分子质量比淀粉更大的多糖,主要存在于肝脏和肌肉中,常常称为动物淀粉,下列有关糖原的叙述正确的是 ( )。
| A.糖原与纤维素互为同分异构体,与淀粉互为同系物 |
| B.糖原水解的最终产物是葡萄糖 |
| C.糖原具有还原性,是还原性糖 |
| D.肌肉中的肌糖原是肌肉内能量的储备形式,运动需要供能,机体可以直接利用肌糖原 |
某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是:
_________________________________________________________________。
(2)燃烧的本质是:_____________________________________________。
(3)2010年8月初发生的俄罗斯森林大火着火面积比伦敦市的面积还要大。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延:_____________________________________________________________。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(4)甲同学认为方案1得到的结论不正确,其理由是:___________________________________
(5)乙同学认为方案2得到的结论正确,白色物质为:________。
(6)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是:_____________________________________________________。
(7)钠在二氧化碳中燃烧的化学方程式为:____________________________
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:
________________________________________________________