味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
查阅资料:资料表明,谷氨酸钠的存在不影响NaCl含量的测定。
设计实验方案:
(1)实验原理:____________________________________________________。
(2)实验试剂:水、试剂X的溶液等。
(3)实验过程:(如图所示)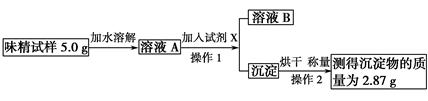
根据上述实验步骤回答下列有关问题:
操作1所需要的玻璃仪器有______________________________________;
用简明扼要的语言描述操作2的过程:_____________________________________________;
通过计算判断该味精中NaCl的质量分数是否符合其包装上标注的标准:
__________________________________________________________________
_________________________________________________________________;
加水溶解所得溶液A为50 mL,则溶液A中NaCl的物质的量浓度是
__________________________________________________________________
________________________________________________________________。
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: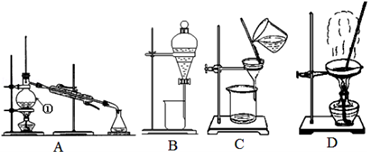
(1)从氯化钠溶液中得到氯化钠固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 ;从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(2)装置A中①的名称是 ,冷却水的方向是______________,温度计水银球的位置是在 ;装置B在分液时装置中的液体不能顺利滴下,原因是______________________。
(3)从碘水中得到碘时,不能选用的试剂是____________
A.酒精 B.苯 C.四氯化碳
若选则试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后,下层液体的颜色为 。
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
Cl- |
Na+ |
SO42- |
Mg2+ |
Ca2+ |
HCO3- |
Br- |
| 含量/(mg·L-1) |
18980 |
10560 |
2560 |
1272 |
400 |
142 |
64 |
(1)以食盐为原料进行生产并综合利用的某些过程如下图所示。
①除去粗盐中的Ca2+、Mg2+和SO 离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
合理的一种顺序是(填序号) 。将滤液的pH调至酸性除去的离子是 。
②电解饱和食盐水的化学方程式是 ;
③侯德榜向饱和食盐水中通入NH3、CO2气体制NaHCO3晶体的化学方程式为 。
其依据是 。
④工业上可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2制取有效成分为NaClO的消毒液,反应的化学方程式是 。(碳酸的酸性强于次氯酸)。
(2)利用海水可以提取溴和镁,提取过程如下:
① 从MgCl2溶液中得到MgCl2·6H2O晶体的主要实验操作是 、洗涤、烘干。从MgCl2·6H2O晶体中得到无水MgCl2的主要方法是
②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_____________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________。
③依据上述流程,若将5 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: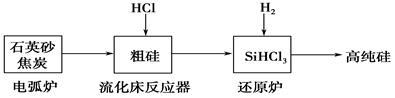
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2 355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。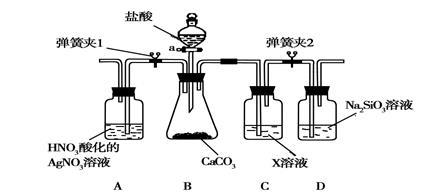
① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。
在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
试回答:
(1) 若用[Ⅰ]制取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时,如若发现c中液面不明显上升,你分析可能的原因是 ,检查的简单方法是 。
(2) 装置(Ⅰ)中b能防止多余气体逸散的原因是: 。
(3) 欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) 理由是: 。
[Ⅲ]是否可行(填“是”或“否”) 理由是: 。