某化学兴趣小组为探究氢氧化钠的化学性质,做了如下图所示的3个实验。试回答下列问题:
(1)实验1:实验结束后观察到试管中溶液呈红色,由此推断,该试管中的指示剂是无色酚酞溶液。
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生。
①写出实验过程中会观察到的现象是 ,反应的化学方程式为
,该反应 (填“是”或“不是”)复分解反应。
②该兴趣小组发现用其他方法也可证明反应的发生:取反应后的溶液,向其中加入 ,其现象是 ,写出该反应的化学方程式 。
(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,他们由此判定氢氧化钠和盐酸不反应。你认为他们的判断是否正确。若不正确,你认为他们的实验可以怎么改进从而可以判断反应是否发生。
(4)某地一辆满载浓硫酸的罐车翻到,导致50t质量分数为98%的浓硫酸泄露,接到报警后的消防官兵赶来后立即用熟石灰处理。若要完全中和泄露的浓硫酸,理论上需要熟石灰多少吨?
在2010年春季,安徽阜阳地区发生了震惊全国的“毒奶粉”事件。劣质奶粉制造商为牟取暴利,大大降低了奶粉中蛋白质的含量,导致食用这种奶粉的众多婴儿严重营养不良乃至死亡。奶粉中蛋白质含量的国家标准为:每100克婴儿奶粉中含12—15克蛋白质。其测定方法是:奶粉经系列反应生成氨,由氨计算出氮元素的质量,再由氮求出蛋白质的质量(蛋白质含氮按16%计算)。今有一袋从农村市场查获的奶粉,取样品100克,反应后生成的氨气和7.5克19.6%的稀硫酸恰好完全反应〔2NH3+H2SO4====(NH4)2SO4〕,试通过计算判断这袋奶粉是否属于劣质奶粉。
市售某种氮肥中,主要成分为尿素[化学式为:CO(NH2)2]若含量在96%以上为达标一级产品。请回答:
⑴尿素的相对分子质量是;其中氢和氧元素质量比为 _____________,氮元素的质量分数为_________。(保留一位小数)
⑵经测定该化肥的氮元素质量分数为45%,请计算确定是否达到一级品标准。
⑶某农民向田里使用50千克的这种化肥,如果改用NH4NO3 需要购买多少千克才能有相同量的氮元素(保留一位小数)
黄梅马鞍山出产铁矿石,经化学分析,铁矿石的主要成分为氧化铁,其中含泥沙等杂质,求:
(1)氧化铁的相对分子质量为。
(2)纯氧化铁中铁元素质量分数为。
二氧化硫工业上可用于生产硫酸,化学方程式为2SO2 + O2 + 2H2O = 2H2SO4,现有32吨SO2气体,欲使它完全转化为硫酸,至少应通入氧气多少吨?
某厂生产的产品碳酸钠中混有少量碳酸氢钠。为了测定产品中碳酸钠的质量分数,取100g样品加热(2NaHCO3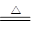 Na2CO3 + H2O + CO2↑ ,碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g。求:
Na2CO3 + H2O + CO2↑ ,碳酸钠受热不分解),完全分解生成二氧化碳气体0.22g。求:
(1)样品中碳酸氢钠的质量。
(2)样品中碳酸钠的质量分数。