B元素与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等且键角也相等,可以判断出BF3分子为__________分子(选填“极性”或“非极性”); BF3晶体的熔点比SiO2晶体________(选填“高”、“低”)。
有X,Y,Z三种元素,X是有机化合物中必含的元素,Y是地壳里含量最多的元素,Z是质量最轻的元素。X和Y能结合成两种化合物A和B,A可以燃烧,B不能燃烧,也不能支持燃烧,X与Z按质量比为3:1组成的化合物C可以燃烧,X、Y、Z三种元素组成的化合物D常用作实验室酒精灯的燃料。
(1)试判断X、Y、Z各是什么元素:
X是____ __ ___,Y是___ ___ ___,Z是____ __ ___(用符号表示)
(2)试判断A、B、C、D各是什么物质?
A是___ ___,B是___ ___,C是_____ _,D是__ ____(用化学式表示)
(3)写出下列反应的化学方程式:
①A燃烧的化学方程式:______
②C燃烧的化学方程式:_______
用电子式表示下列物质:Cl2 ________ KI________
由铜、锌和稀盐酸组成的原电池中,铜是________极,发生________反应,电极反应式是________;锌是________极,发生________反应,电极反应式是________。
从能量的角度看,断开化学键需要________,形成化学键需要________。
某研究性学习小组为了研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。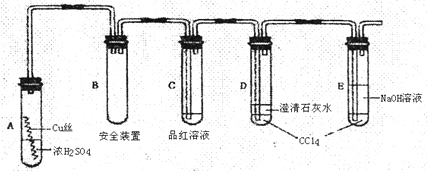
以下是该学习小组部分交流记录及后续探究实验的记录。
材料一:小组交流滴录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝
聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S=Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色。
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)D、E两支试管中CC14的作用是;
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:;
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
;
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是;(写化学式)
(5)反应完全后稀释溶液呈酸性,学生2猜想反应中浓硫酸可能过量,请你设计一个简单的实验以验证稀释后的溶液由于硫酸过量呈酸性,。