(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且
则断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差为__________KJ。
(2)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ·mol-1) |
786 |
715 |
3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高 到低的顺序是 。
(3)已知AlCl3熔点190℃,沸点183℃,结构如右图所示:AlCl3晶体内含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键
D.配位键 E.范德华力 F. 氢键
(4)氯和钾与不同价态的铜可生成两种化合物,这两种化合物中的阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 ,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 。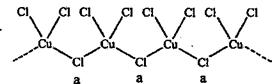
.酒石酸是某种降压药物的载体,可用1,3-丁二烯为原料合成,其流程如下: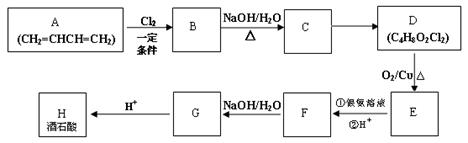
已知:①
② D的分子组成是C4H8O2Cl2,核磁共振氢谱显示其有三个峰。
(1)D中所含官能团的名称是。
(2)C转化为D的反应类型是。
(3)B存在顺反异构,它的顺式结构简式是。
(4)写出A生成B的化学方程式。
(5)与C组成相同、属于酯类、能发生银镜反应的有机化合物的结构简式。
(6)F转化为G的化学反应方程式是。
(7)F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是___________。
.填出实现下列转变所需的药品(均为常见的无机试剂)
①③④⑤
. 有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
⑴该化合物分子中含有个氧原子。
⑵化合物化学式为
⑶该化合物最多含有_______个羰基。
.根据下列信息写出符合要求的有机物的结构简式.
(1)若某有机物的分子量为128,若该有机物为链烃,则分子式为___________,若该烃一氯代物只有二种,则该烃的结构简式为______________或_____________,若该烃为芳香烃,则分子式为_____________,则该烃的结构简式为______________,若该有机物为烃的含氧衍生物,且是饱和一元的有机物,则其分子式为________________
(2)某有机物仅由C、H、O三种元素组成,且C、H、O原子个数之比为1:2:1,若该有机物为醛类,则其结构简式为:_______,若该有机物为羧酸,则其结构简式为_______,若该有机物为酯类,则其结构简式为_______,若该有机物为糖类,则其结构简式为_______,若该有机物分子式为C3H6O3,且两分子该有机物可形成六元环状酯,则C3H6O3结构简式为________________
. 核磁共振谱是测定有机物分子结构最有用的工具之一。瑞士科学家维特里希等三人即是利用核磁共振技术测定生物大分子的三维结构而获得2002年诺贝尔化学奖。在有机物分子中,不同位置的氢原子在核磁共振氢谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为: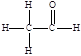 ,其PMR谱中有2个信号峰,其强度之比为3∶1。
,其PMR谱中有2个信号峰,其强度之比为3∶1。
⑴下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是()
| A.CH3-CH3 | B.CH3OCH3 | C.CH3CH2OH | D.CH3CH2Cl |
⑵化合物A和B的分子式都是C2H4Br2,A的PMR谱上只有1个峰,则A的结构简式为。
B的PMR谱上有个峰,强度比为
(3)化合物分子式是C8H10,含苯环,其多种同分异构体中有一种在PMR谱上只有3个信号峰,强度比为3:1:1,其结构简式为。