氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。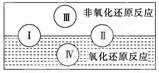
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。
化学式为 C2H6O 的有机物能与钠反应,它的名称是_________;俗名是______________。
有一包白色粉末,可能含有下列离子中的若干种。
阳离子:K+、Na+、Fe2+、Fe3+、Cu2+、NH4+、Mg2+;
阴离子:Cl-、SO42-、SO32-、CO32-、HCO3-、S2-、MnO4-;
进行如下实验:①取少量试样加水则全溶解,溶液呈无色透明 ②将所得溶液加入NaOH并加热,无可见现象 ③取少量原粉末加入盐酸,无可见现象
(1)从实验①可推知粉末中无离子;
(2)从实验②可推判不可能有离子;
(3)根据实验③可推判粉末中无离子,综上所述,该粉末中可能含有离子。
F可用作化肥,也可用来制炸药,化合物和单质间存在如下关系:
(1)写化学式:A,F。
(2)A→C转化的化学方程式:______________________
(3)试写出一种由E制得D的反应的方程式:
钢铁发生吸氧腐蚀时,正极发生的反应为:,负极发生的反应为:。
在NaHCO3溶液中,C(H+)+C(Na+)=。
C(HCO3-)+C(CO32-)+C(H2CO3)=。