溴主要以形式存在于海水中,海水呈弱碱性。工业上制备的的操作步骤为:
①一定条件下,将通入浓缩的海水中,生成
②利用热空气将吹出,并用浓溶液吸收,生成、等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)氧化应在条件下进行,目的是为了避免。
(2)可用热空气吹出,其原因是。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是。步骤②的产品有时运输到目的地后再酸化,主要是因为.
(4)为了除去工业Br2中微量的,可向工业中。
a.通入 b.加入溶液 c.加入溶液 d.加入溶液
有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32—、SO42—等离子中的几种,为分析其成分,取此溶液分别进行四个实验:
①蘸取溶液进行焰色反应(透过蓝色钴玻璃)显紫色,
②加入盐酸酸化的氯化钡溶液,出现白色沉淀,
③加入过氧化钠固体,产生无色无味的气体和白色沉淀,
④取100 mL该溶液逐滴加入过量的5 mol·L-1氢氧化钠溶液,生成白色沉淀与加入氢氧化钠的量如图: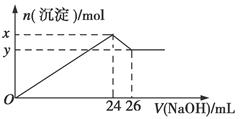
(1)原溶液中一定不存在的离子:____________________________。
(2)为满足溶液中一定存在的离子要求,一般可溶解两种常见的物质,其化学式为________、________。
x-y=________mol。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为________(填字母)。
A.Br-B.SO42- C.CH3COO-D.HCO3-
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式:________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是________。
(4)若用惰性电极电解C和D的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阴极析出固体的质量m与通过电子的物质的量n的关系。(标明纵坐标数值)
(5)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________________________。
工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2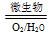 Fe2++SO42—
Fe2++SO42—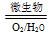 Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。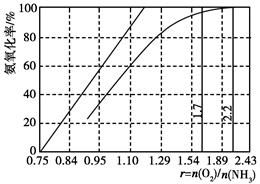
对物质净化对生产生活有很重要的意义。
(1)除去水中的Ca2+、Mg2+等阳离子,完成此目标可使用________(填材料名称)。
(2)催化还原法可以净化硝酸工业尾气,下列物质中不能用于除去尾气中氮氧化物的是________。
| A.NH3 | B.CH4 | C.CO2 | D.H2 |
(3)接触法制硫酸的工艺中,沸腾炉产生的炉气必须经过净化,除去其中的粉尘和________,净化后的炉气进入________(填设备名称)。
(4)煤的气化技术的主要产物是________,将煤加工以得到焦炉气、煤焦油及焦炭等产品的技术称为________。