某学生对与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4漂粉精固体,加入100水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的 | 试纸先变蓝(约为12),后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)和制取漂粉精的化学方程是
(2)试纸颜色的变化说明漂粉精溶液具有的性质是
(3)向水中持续通入,未观察到白雾。推测现象的白雾由小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的溶液检验白雾,产生白色沉淀。
① 实验目的是
②由实验不能判断白雾中含有,理由是
(4)现象中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和发生反应。通过进一步实验确认了这种可能性,其实验方案是
(5)将瓶中混合物过滤、洗涤,得到沉淀
①向沉淀中加入稀,无明显变化。取上层清液,加入溶液,产生白色沉淀。则沉淀中含有的物质是
②用离子方程式解释现象中黄绿色褪去的原因:
某天然碱样品的组成可能为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),为确定其组成,某小组进行如下实验:
(1)定性实验:
①取少量样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝,能否说明样品中是否含结晶水,简述理由_______________________。
②请设计一个简单方案,确认样品中含有CO32-_________________________。
(2)定量分析: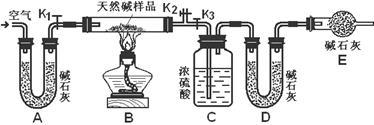
实验步骤:
①组装好实验装置后,首先进行的操作是______;A处碱石灰的作用是_________,E处碱石灰的作用是___________________________________。
②称7.3克样品,放入硬质玻璃管中,称量C装置质量为87.6克,D装置为74.7克。
③打开活塞k1、k2,关闭k3,通入空气数分钟。
④关闭k1、k2,打开k3,点燃酒精灯至不在产生气体为止。
⑤打开k1,鼓入空气数分钟,然后称得C装置质量为88.5克,D装置质量为75.8克,通入空气数分钟的目的是___________________________________。
⑥该天然碱的化学式为:_______________________________。
某研究性学习小组的同学利用下列装置进行乙醇催化氧化的实验。请分析回答:
(1)请写出实验过程中的总的化学反应方程式__________________________。
(2)在不断鼓入空气的情况下,移去酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是________反应。进一步研究表明,鼓气速度与反应体系的温度关系曲线如右图所示。鼓气速度过快,反应体系温度反而下降的原因___________________________。
(3)甲和乙两个水浴作用不相同。
甲的作用是________________;乙的作用是_________________________。
(4)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是___________。集气瓶中收集到的气体的主要成分是_______________。
(5)在检验生成物的过程中,一位同学很偶然地发现向溴水中加入乙醛溶液,溴水褪色。针对溴水褪色的原因,该小组的同学们经过分析后,提出两种猜想:
①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?_______________________。
某化学课外活动小组欲制取纯碱Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:A大理石;B盐酸;C氢氧化钠溶液;D澄清石灰水。
三名同学设计的制备方案的反应流程分别如下: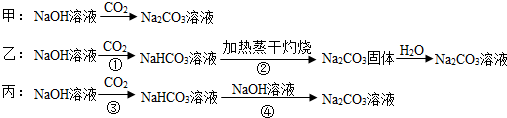
(1)请指出甲、乙两方案的主要缺点:
甲方案_______________________;
乙方案_______________________;
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有______________________;
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3.乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的? ______________(填“能”或“不能”)若能,请说明其计算所需的数据;若不能,请简要说明理由______________。
三氯化碘(ICl3,I的化合价为+3价)在药物合成中用途广泛,其熔点:33℃,沸点:73℃,实验室可用如图装置制取ICl3。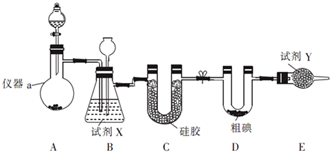
(1)制备氯气选用的药品为漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为:____________________________;
试剂X为________________、Y为______________;
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象____________________________;
(3)某同学欲测定ICl3样品中ICl3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI═2I2+3KCl(样品中杂质不反应).将所得溶液配置成100mL待测液.取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为____________________________;重复滴定,实验数据记录如下:
| 滴定次数 |
待测液体积/mL |
Na2S2O3标准液体积/mL |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
| 第三次 |
25.00 |
4.20 |
26.70 |
该样品中ICl3的质量分数为_______________(ICl3相对分子质量为233.5)
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下: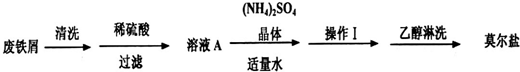
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________;
(2)浓度均为0.10mol•L-1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者______后者.(填“大于”、“小于”或“等于”或“无法判断”)
(3)0.10mol•L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(4)常温下,若0.10mol•L-1(NH4)2SO4溶液的pH=5,求算NH3•H2O的电离平衡常数Kb≈________;