25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是 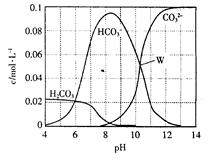
| A.W点所示的溶液中:c (Na+)+c (H+)="2c" (CO32— )+c (OH— )+c (Cl— ) |
| B.pH= 4的溶液中:c (H2CO3)+c (HCO3—)+c (CO32—)<0.1mol·L—1 |
| C.pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3—)=" c" (OH— )+c (Cl— ) |
| D.pH=11的溶液中:c (Na+)>c (Cl— )>c (CO32— )>c (HCO3— )>c (H2CO3) |
2010年上海世博会将实现环保世博、生态世博目标,下列做法中不符合这一目标的是()
| A.部分国家的展馆使用可降解的建筑材料 |
| B.把世博会期间产生的垃圾焚烧或深埋处理 |
| C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| D.停车场安装了催化光解设施,用于处理汽车尾气 |
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.该体系中有CaF2沉淀产生 |
C.该体系中KSP(CaF2)=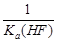 |
D.KSP(CaF2)随温度和浓度的变化而变化 |
某温度下,将2 mol A和3 mol B充入一密闭的容器中发生反应:aA(g)+B(g)
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为( )
| A.40% | B.60% | C.24% | D.4% |
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/ mol·L-1 |
0.010 |
0.020 |
0.020 |
| c(CO2) / mol·L-1 |
0.010 |
0.010 |
0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中CO2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
① CH4 (g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g)△H=-574 kJ·mol-1;
② CH4 (g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1。
下列说法不正确的是( )
| A.由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867 kJ·mol-1 |
| B.等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 |
| C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |