根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。
(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/ mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断该试样的酸碱性为 ,试样的pH值=
②已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1 mol空气含有0.8 molN2和0.2 molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8 × 10-4 mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g)ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g)ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g)ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号) 。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是 。
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、 、
、 、
、 等含一个碳原子的物质为原料合成工业产品的化学与工艺。
等含一个碳原子的物质为原料合成工业产品的化学与工艺。
(1)将 转化成有机物可有效实现碳循环。
转化成有机物可有效实现碳循环。 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a.
b.
c.
d.
在以上属于人工转化的反应中,原子利用率最高的是 (填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入 和
和 ,在催化剂作用下合成甲醇:
,在催化剂作用下合成甲醇:

 。平衡时CO的转化率与温度、压强的关系如图。
。平衡时CO的转化率与温度、压强的关系如图。
①该反应属于 反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数 值很大,对此反应的说法正确的是 (填序号)。
值很大,对此反应的说法正确的是 (填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
② 时,该反应的平衡常数
时,该反应的平衡常数 (用
(用 的代数式表示)。
的代数式表示)。
(3)二甲醚( )被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.



b.



c.



总反应:

 的
的 。
。
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母)。
a.
b.容器内压强保持不变
c. 的浓度保持不变
的浓度保持不变
d. 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为 。
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、 等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO
等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NO )在有催化剂的条件下反应的化学方程式 。
)在有催化剂的条件下反应的化学方程式 。
(8分)(1)有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol·L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如右图所示。请回答下列问题: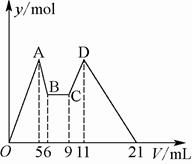

①上述 HCl溶液的浓度c= mol/L。
②所加NaOH溶液的体积为( )
| A.9 mL | B.7.5 mL | C.7 mL | D.6 mL |
(2)向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。(已知氧化性:Br2> Fe3+>I2)请回答下列问题:
① 原混合液中n(FeBr2)= mol ;
原混合液中n(FeBr2)= mol ;
②a值等于 。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是
①________ ,②________ ,③________ ,④_______ _。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
| 实验① |
实验② |
实验③ |
|
| 取甲瓶溶液的量 |
400 mL |
120 mL |
120 mL |
| 取乙瓶溶液的量 |
120 mL |
440 mL |
400 mL |
| 生成沉淀的量 |
1.56 g |
1.56 g |
3.12 g |
①甲瓶溶液为_______ _ 溶液。
②乙瓶溶液为________ 溶液,其物质的量浓度为________mol·L-1。