以下为五种有机物的有关信息,根据表中信息回答问题。
| A |
B |
D |
E |
F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶。 |
其产量用来衡量一个国家的石油化工水平。 |
比例模型为: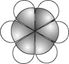 |
①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体。 |
由5个原子组成的10个电子的共价分子。 |
(1)A的官能团名称为________,对A的描述正确的是_________。
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤ B.②③④ C.③④⑥ D.④⑤⑥
(2)B的电子式为 ,把一定体积的B、F混合气体通过溴水,有 反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为 g。(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
(3)工业上,D来源于煤干馏后的液态产物煤焦油。D在浓硫酸、50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为 。
(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件)。 。下图为实验室进行该反应时的装置图,其中有 处错误。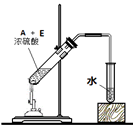
有一个食品广告称:“我公司生产的新型糕点不含糖,是糖尿病人的最佳选择”。下表是其包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品名 |
XXX |
| 配料 |
鲜鸡蛋,精面粉,精炼植物油,碳酸氢钠, 甜蜜素,柠檬黄,苯甲酸钠等 |
| 保质期 |
120天 |
| 生产日期 |
标于包装袋封口上 |
(1)富含油脂的是_____________________
(2)富含糖类的是______________________
(3)富含蛋白质的是____________________
(4)属于防腐剂的是___________________
(5)属于着色剂的是__________________
(6)属于调味剂的是____________________
(7)属于疏松剂的是___________________
(8)请分析广告的说法是否科学?____________(填“是”或“否”)
淀粉和纤维素的分子组成都可以用通式 _____表示,但二者的n值是_____的(填“相同”或“不同”)。它们都属于_____糖,在性质上跟单糖、二糖不同,没有_____味,都_____发生(填“能”或“不能”)发生银镜反应,但稀硫酸的催化作用下,都能发生_____反应。
在25℃时,向100ml含氯化氢14.6g的盐酸溶液里放人5.60g纯铁粉(不考虑反应前后溶液体积变化),反应开始至2min末,收集到1.12L(标准状况)氢气。在此之后,又经过4min,铁粉完全溶解。则:
(1)在前2min内用FeCl2表示的平均化学反应速率是_______
(2)在后4min内用HCl表示的平均化学反应速率是_______
(3)前2min与后4min相比,反应速率较快的是 ________,其原因是_____
写出常温时,下列反应的热化学方程式:
(1)3molNO2(g)与1mol H2O(l)反应生成HNO3(aq)和NO(g),放热138kJ。
(2)用CO还原1mol Fe2O3,放热24.8 kJ。
(3)1molHgO(S)分解为液态汞和氧气,吸热90.7 kJ。
(4)0.2mol NaOH与稀H2SO4完全反应放热11.46 kJ,写出表示酸与碱反应中和热的热化学方程式:
(5)0.1g H2完全燃烧放出热量12.1 kJ,写出表示H2燃烧热的热化学方程式:
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。
已知:① P4(s,白磷)+5O2(g)=P4O10(s) △H =-2983.2kJ/mol
② P(s,红磷)+5/4O2(g)=1/4P4O10(s) △H ="-738.5kJ/mol"
则白磷转化为红磷的热化学方程式为___________。相同状况下,能量状态较低的是__________________;白磷的稳定性比红磷________(填“高”或“低”)。