"五一"假期,小兵对"锌与硫酸反应快慢的影响因素"进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】
.可能与硫酸的质量分数有关;
.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数(均取20mL) |
锌的形状(均取1g) |
氢气的体积(mL)(均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
20% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出稀硫酸与锌反应的化学方程式
(2)小兵用右图装置收集并测量氢气的体积,其中量筒的作用是
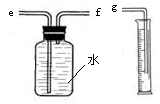
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是
【得出结论】(4)结论是
【评价与反思】(注意:若答对(5)(6)两小题奖励4分,化学试卷总分不超过60分)
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) |
第1分钟 |
第2分钟 |
第3分钟 |
第4分钟 |
第5分钟 |
第6分钟 |
| H2的体积 |
3.1mL |
16.7mL |
11.9mL |
9.6mL |
7.6mL |
6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。
2021年5月15日7时18分,天问一号探测器着陆火星,我国星际探测征程迈出了重要的一步。
(1)火星北极的土壤呈弱碱性。如果火星具备作物生长的其他条件,下表所列作物适宜在火星北极种植的是 。
|
作物名称 |
茶树 |
棉花 |
水稻 |
甘草 |
|
适宜生长的pH |
5.0~5.5 |
6.0~6.8 |
6.0~7.0 |
7.2~8.5 |
(2)火星上含有丰富的二氧化碳和镁资源。科学家设想用镁作为未来火星上的燃料,因为镁能在二氧化碳中燃烧放出大量的热,同时生成一种氧化物和一种单质。该反应的化学方程式为 。
下表是氯化钠和硝酸钾在不同温度下的溶解度。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
|
请回答下列问题:
(1)30℃时,硝酸钾的溶解度为 。
(2)使硝酸钾饱和溶液变为不饱和溶液,可采用的一种方法是 。
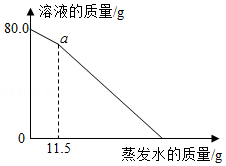
(3)50℃时,将80.0g一定质量分数的氯化钠溶液恒温蒸发,溶液的质量随蒸发水的质量变化关系如图所示,则a点溶液中溶质的质量为 。
(4)下列有关说法正确的是 (填标号)。
A.与氯化钠相比,硝酸钾的溶解度受温度影响较大
B.除去硝酸钾中混有的氯化钠,可采用降温结晶的方法
C.20℃时,向40.0g质量分数为25%的氯化钠溶液中加入10.0g氯化钠,可得到40%的氯化钠溶液
D.40℃时,分别向氯化钠和硝酸钾的饱和溶液中加入等量的水,所得溶液的质量分数可能相等
化学与生活息息相关,如图为生活中的常见物品。

请回答下列问题:
(1)碳酸钙可用作补钙剂,它的化学式为 。
(2)淀粉的化学式为(C6H10O5)n,其中C、H、O三种元素的原子个数比为 。
(3)天然气的主要成分是甲烷(化学式为CH4),甲烷燃烧的化学方程式为 。
A﹣F为初中化学中常见的六种物质。其中E是一种碱,它广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。它们之间的转化是初中常见的化学反应,转化关系如图所示(“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。请回答下列问题:
(1)E的化学式: ;
(2)C→F的反应属于 反应(填基本反应类型);
(3)写出F→E的化学方程式: ;
(4)A不可能的物质类别是: (填“单质”、“氧化物”、“酸”、“碱”、“盐”中的一种)。

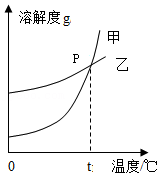
K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图:
|
温度/℃ |
20 |
30 |
50 |
60 |
80 |
|
|
溶解度/g |
K2CO3 |
110 |
114 |
121 |
126 |
139 |
|
KNO3 |
31.6 |
45.8 |
85.5 |
110 |
169 |
|
(1)图1中能表示K2CO3溶解度曲线的是 (填“甲”或“乙”)。
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为 g。
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1 w2(填“>”、“=”或“<”)。
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和溶液的方法是: 。