X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子序数由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: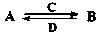 (在水溶液中进行)
(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的化学式 ;D的电子式 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 ;A、B浓度均为0.1mol·L-1的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。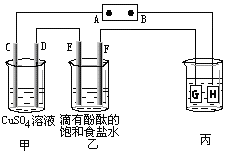
请回答:
(1)A极是电源的,甲装置观察到的现象是、
、。
(2)C极的电极反应式为。
(3)现用丙装置给铜件镀银,则H应该是(填“镀层金属”或“镀件”),电镀液是溶液。
阅读下表中部分短周期主族元素的相关信息:
请回答:
| 元素代号 |
相关信息 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期的所用金属离子中,Y的离子半径最小 |
| Z |
Z与Y同周期,是所在周期中原子半径最小的元素 |
| T |
T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为,该化合物中所含的化学键有(填化学键名称)。
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
、。
已知强酸与强碱反应的中和热为—57.3KJ/mol,请写出硫酸溶液与氢氧化钠溶液反应的中和热的热化学方程式。
常温下,有下列三种溶液:①0.1 mol/L NH4Cl②0.1 mol/L NH4HCO3③0.1 mol/L NH4HSO4
请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是:
(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②③﹝填“>”、“<”或“=”)
甲醇是一种优质的液体燃料,CO和CO2均可用于合成甲醇。
目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g)△H1
(1)已知:2CO(g) +O2(g) =2CO2(g)△H2
2H2(g)+O2(g) =2H2O(g)△H3
则CO(g) + 2H2(g)  CH3OH(g)的△H=。
CH3OH(g)的△H=。
(2)由CO合成甲醇时,CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
(3)
一定温度下,向2L密闭容器中加入1mol CH3OH (g),发生反应:CH3OH(g)  CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)=。
CO(g) + 2H2(g),H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(CH3OH)=。
该温度下,CO(g) + 2H2(g)  CH3OH(g)的平衡常数K=。
CH3OH(g)的平衡常数K=。
相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.CH3OH的平衡浓度 c.达到平衡的时间 d.平衡时气体的密度
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。
①充入CH3OH的电极为极;
②负极反应的电极反应式为。